
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типи регуляції іонних каналівСодержание книги
Поиск на нашем сайте
ЛЕКЦІЯ №9 на тему: ІОННІ КАНАЛИ ТА 1) Типи регуляції іонних каналів; 2) Поверхневий потенціал клітини; 3) Мембранний потенціал; 4) Потенціал дії та його види; 5) Поширення ПД. Кабельна теорія; 6) Воротні струми іонних каналів; Типи регуляції іонних каналів КАНАЛЬНІ БІЛКИ Канальні білки в залежності від типу стимулу поділяють на: - Потенціалкеровані (потенціалзалежні) – регулюються зміною мембранного потенціалу; - Механочутливі - регулюються зміною мембранного натягу; - Лігандкеровані – вплив певних хімічних сполук; розділяють на опосередковані та безпосередні. Іонні канали відкриваються у відповідь на різний стимул. Ключем механізму до регуляції є потенціал, ліганд та механічний натяг мембрани. Іонні канали є іонселективними Конформаційні зміни канальних білків (ворітні механізми) переводять із закритого стану у відкритий.
Іонні канали мають ворота Вони також Можуть інактивуватися Iнактивація може проходити декількома механізмами ТИПИ іонних каналів: ü Прості пори (GA, GAP junctions) ü Ліганд-керовані канали (Nicotinic receptor) ü Потенціал-залежні канали (K-channels) ü Помпи (ATP-synthase, Na+, K+- ATPase) РОДИНИ КАНАЛІВ Ú Потенціал-залежні Ú Ліганд-керовані (Extracellular та Intracellular) Ú Вхідного виправлення Ú Міжклітинні Ú Інші ПОТЕНЦІАЛ-ЗАЛЕЖНІ Ú Na+ (sodium): I, II, III, µ1, H1, PN3 Ú K+ (potassium): KA, Kv (1-5), Kv(r), Kv(s),KSR, BKCa, IKCa, SKCa, KM, KACh Ú Ca2+ (calcium): L, N, P, Q, T Ú Cl- (chloride): ClC-0 - ClC-8 ЛІГАНД-КЕРОВАНІ Extracellular ligand-gated
Ú nicotinic ACh (muscle): a2dgb (embryonic), a2deb (adult) Ú nicotinic ACh (neuronal): a(2-10), b(2-4) Ú glutamate: NMDA, kainate, AMPA Ú P2X (ATP) Ú 5-HT3 Ú GABAA: a(1-6), b(1-4), g (1-4), d, e, r(1-3) Ú Glycine ЛІГАНД-КЕРОВАНІ (Intracellular ligand-gated) Ú leukotriene C4-gated Ca2+ Ú ryanodine receptor Ca2+ Ú IP3-gated Ca2+ Ú IP4-gated Ca2+ Ú Ca2+-gated K+ Ú Ca2+-gated non-selective cation ВХІДНОГО ВИПРАВЛЕННЯ Ú Kir – 1.1-1.3 – 2.1-2.4 – 3.1-3.5 – 4.1-4.2 – 5.1 – 6.1-6.2 – 7.1 МІЖКЛІТИННІ Ú Канали щілинних контактів – Cx26 – Cx32 – Cx37 – Cx40 – Cx43 – Cx45 – Cx50 – Cx56 ІНШІ Ú Механочутливі Ú Мітохондріальні Ú Ядерні Ú Аквапорини Ú Везикулярні (synaptophysin) Поверхневий потенціал клітини На зовнішній поверхні клітин, зокрема збудливих, розташовані аніонні групи, що несуть негативні заряди, а також декілька позитивно заряджених протонованих аміногруп. Через суттєве домінування аніонних груп на поверхні створюється сумарний негативний поверхневий потенціал. Розглядаючи структури, що несуть заряди, слід врахувати цвітер-іони, голівки фосфоліпідів, залишки сіалової кислоти. Поверхневий потенціал мембрани впливає на примембранні концентрації іонів й на сенсори напруги потенціалзалежних іонних каналів. Відстань від мембрани, на яку поширюється електростатична дія її поверхневих зарядів, характеризується дебаєвською довжиною, що залежить від іонної сили. Наприклад, дебаєвська довжина для розчину Рінгера – 0,9 нм, для морської води – 0,46 нм. Дійсне значення поверхневого потенціалу мембрани (Еm) зображено на рисунку і визначається наступним чином: Для кількісного опису феноменів, пов'язаних зі зміною поверхневого потенціалу клітин і штучних мембран, широко використовують модель Гуі-Чапмена. За цією моделлю плоска поверхня має рівномірно розподілені заряди, що містяться в розчині електроліту. На іони у примембранному просторі діють електростатичні сили, завдяки яким створюється подвійний електричний прошарок.
де Еm/ – дійсне значення мембранного потенціалу; Еm – виміряний експериментально МП; ψо – зовнішній поверхневий потенціал; ψ і – внутрішній поверхневий потенціал. Мембранний потенціал Між обома поверхнями плазматичної мембрани клітини підтримується різниця електричних потенціалів – мембранний потенціал (вимірюється у мВ). У 1902 р. Ю.Бернштейн висунув першу обґрунтовану гіпотезу щодо походження потенціалу спокою в нервових та м'язових волокнах. З результатів хімічного аналізу було відомо, що протоплазма волокон має високий вміст іонів К+. Тому вчений припустив, що МП виникає внаслідок нерівномірного розподілу іонів калію й може бути розрахований при використанні рівняння Нерста
Рівняння Нерста
При фізіологічних значеннях [K+]o та [K+]i. (1/20) EK<0 Мембранний потенціал Е називають потенціалом нульового струму, абопо рівні сторони мембрани потенціалом реверсії. Теорія постійного поля Гольдмана-Ходжкіна-Катца передбачає залежність мембранного потенціалу від проникності та концентрації іонів. Перевірити дану гіпотезу неможливо було, бо не було достовірного та можливого методу. Лише коли вчені Ходжкін, Хакслі (1939) та Коул, Кертіс (1942) незалежно один від одного виготовили та ввели скляні піпетки-електроди в гігантський аксон кальмара. Електричні сигнали, що реєструють у клітині, можуть бути двох типів: потенціали дії та різноманітні повільні потенціали. У плазматичній мембрані наявні іонні канали, що регулюються мембранним потенціалом (потенціалзалежні), їх уперше виявили у нервових та м'язових клітинах. У відповідь на деполяризацію мембрани (плюсове зміщення МП) відбувається активація (перехід з непровідного у провідний стан) потенціалзалежних іонних каналів. Відкриття цих каналів веде до виникнення іоннних струмів і деполяризації незбуджених ділянок мембрани. Формується сигнал, котрий має здатність самопоширюватися та самопідтримуватися – ПОТЕНЦІАЛ ДІЇ (ПД). Потенціал дії та його види Іонні механізми виникнення потенціалу дії в нервових волокнах стали зрозумілими завдяки дослідженням ПОТЕНЦІАЛ ДІЇ ПД виникає при зміщенні МП до критичної величини, названої порогом. Локальна відповідь - початковий етап деполяризацii Коул та Кертс (1939) встановили, що під час ПД опір мембрани зменшується у 25 разів – з 1000 до 40 Ом·см2, а ємність не міняється. Зміщення МП до -45 мВ приводить до виникнення ПД. А. Ходжкін і Б. Катц встановили, що збільшення провідності мембрани під час виникнення ПД зумовлено головним чином підвищенням натрієвої провідності для мембрани, в результаті чого виникає Na+-струм, який спрямований усередину клітини. Зміни які проходять мають регенеративний характер, деполяризація мембрани збільшує проникність для Na+, що зумовлює подальшу деполяризацію сусідньої ділянки мембрани, що супроводжується зміною знаку МП. Фаза деполяризацii - швидке зниження мембранного потенціалу до нуля і перезарядження мембрани (реверсія, або овершут). Позитивне зміщення МП не лише активує натрієві канали, але водночас спричинює більш повільний процес, названий інактивацією, який виявляється у зменшенні кількості функціонуючих каналів. Під час ПД вільно підвищується калієва провідність мембрани. У результаті інактивації натрієвої провідності мембрани й підвищення калієвої створюються умови реполяризації ПД й обмеження її тривалості. Фаза слідової гіперполяризації – провідність мембрани для іонів калію є більш високою, ніж у стані спокою, у звязку з чим МП наближається до калієвого рівноважного потенціалу. Важливим наслідком інактивації натрієвих каналів є рефрактерність. Спостерігають абсолютний період – коли нервове волокно не збуджується за жодних умов; Відносний період – під час якого поріг виникнення ПД підвищується. Для максимального ПД мінімально необхідна кількість іонів натрію – 10-12 моль·см-2, фактично експерименти показали, що у волокно проникає втричі більше іонів, це зумовлено перекриванням періодів високої проникності мембрани для різних іонів. При реєстрації ПД за допомогою мiкроелектродної техніки спостерігається типовий пікоподібний потенціал. Амплітудно-тимчасові характеристики потенціалу дії нерва, скелетного м'яза такі: • амплітуда потенціалу дії 140-150 мВ; • тривалість піка потенціалу дії (фаза деполяризацii + фаза реполяризацii) складає 1 -2 мс; • тривалість слiдових потенціалів - 10-50 мс. ВИДИ ПОТЕНЦІАЛІВ ДІЇ Форма ПД (при внутрішньоклітинному відведенні) залежить від виду збудливої тканини: в аксона нейрона, кістякового м'яза - шпилясті потенціали, у гладких м'язів в одних випадках шпилясті, в інших - платопод i бн i (наприклад, потенціал дії гладких м'язів матки вагітної жінки - платоподiбний, а тривалість його складає майже 1 хвилину). У серцевого м'яза потенціал дії має платоподiбну форму Методи фіксації ПД Метод фіксування потенціалу дає змогу безпосередньо реєструвати іонні струми, що протікають через мембрану за даного рівня МП. Уперше цей метод застосували К. Коул (1949), потім А. Ходжкін, А. Хакслі, Б. Катц (1952). Метод полягає у тому, що МП на обмеженій ділянці мембрани майже миттєво зміщують до певного нового значення й утримують на цьому рівні за допомогою схеми із зворотнім зв'язком. Струм, що протікає через мембрану вимірюють окремим підсилювачем. q Використовуючи метод фіксації потенціалу, всі ділянки всередині гігантського аксона кальмара з'єднували металевим електродом замість кабелю, при цьому розглядали нерв як ізольований фрагмент мембрани; q Точковий метод запропонований П.Г. Костюком – 2 кінчики мікроелектродів вводили у сферичну клітину; q Фіксація потенціалу з перфузією – до ізольованої клітини прикладають мікропіпетку і присмоктують, руйнуючи ділянку мембрани; q Петч-клемп (patch clamp) – метод фіксації ПД на певному ізольованому фрагменті мембрани (утворюється гігаомний контакт), ввели у 1976 році Неєр і Сакман. Мікроелектроди Застосування методів Ú Аналіз електричних явищ в клітинній мембрані; Ú Аналіз іонних струмів через канали; Ú Аналіз часових характеристик струму; Ú Аналіз мембранної ємності; Ú Аналіз транслокації обмінників та транспотерів. Іони “протікають” через прості канали АТФ-контрольовані канали Р2Х рецептори (7 ізоформ) складаються з 3 гомологічних субодиниць Родина Цис-петлі Нікотиновий та гліциновий рецептори, деякі глутамат-активовані іонні канали, ГАМКА та ГАМКС рецептори, складаються з 5 субодиниць
Розрізняють два види цих каналів – в залежності від розташування ділянки зв'язування ліганду: - Зовнішньоклітинна ділянка; - Внутрішньоклітинна ділянка ФУНКЦІОНАЛЬНІ ДОМЕНИ Ú Іонселективний фільтр; Ú Сенсор електричної напруги – містить позитивно заряджені залишки амінокислот, котрі реагують на зміну мембранного потенціалу; Ú Інактиваційні ворота – відкриває/закриває іонний канал, котролюється сенсором. Механічний натяг мембрани індукує конформаційні зміни у білків каналів. Це у свою чергу змінює проникність іонних каналів для іонів. БЛОКАТОРИ. Потенціалзалежні Na+-канали є мішенями для дії низки природних та синтетичних токсинів. Ідентифіковано приблизно 6 спеціалізованих рецепторів, котрі взаємодіють з токсинами. Існує 2 види блокування Na+-каналів: ² зв'язування безпосередньо в порі каналу, що блокує проходження іона через канал; ² алостеричне зв'язування агента макромолекулярними структурами рецептора на зовнішній поверхні мембрани Існує 2 класи ТОКСИНІВ-МОДУЛЯТОРІВ Na+-каналів: ² розчинні в ліпідах стероїди, такі як рослинні алкалоїди вератридин та аконітин, отрута батрахотоксин (секрет залоз південноамериканської жаби Phyllobates) – забезпечують стійку активацію натрієвих каналів навіть за ПС, завдяки зміщенню потенціалзалежності активації каналів у напрямку більш негативних значень МП; ліпофільна природа токсинів зумовлює їхню дію як при зовнішньо- так і внутрішньоклітинному застосуванні. ² пептидні токсини отрути скорпіонів (харібдотоксин) і анемон – вибірково конкурентно взаємодіють з рецептом, розташованим біля зовнішнього входу в Na+-канал. ПАЛІТОКСИН Токсичність: • Механізм дії – не повязаний з іонними каналами, а блокує трансформацію Na+,К+-помпи в канал. ТОКСИНИ-МОДУЛЯТОРИ Такі токсини збільшують тривалість ПД нервових волокон у сотні разів унаслідок уповільнення інактивації Na+-каналів – α-токсинами. В отруті скорпіонів містяться токсини, що впливають на механізми активації Na+-каналів – (β-токсини) – канали залишаються відкритими впродовж сотень мілісекунд після повернення МП до рівня ПС. БЛОКАТОРИ Na+-каналів відіграють важливу роль в ідентифікації каналів та іонних струмів. До таких речовин належить тетродотоксин та сакситоксин, які зв'язуються з центральним локусом, розташованим у зовнішньому вході Na+-каналу і блокується провідність внаслідок оклюзії пори. САКСИТОКСИН Токсичність: • Сакситоксин міститься у джгутикових (Gonyaulax); • Механізм дії – зв'язується з потенціалзалежними Na+-каналами і блокує Na+- струм. Клініка: • Швидка відповідь; • Оніміння губ, язика, кінцівок; • Легенева недостатність, серцева аритмія; • Летальність – кома; • Відновлення 4/5 днів; ТЕТРОДОТОКСИН Тетродотоксин мітиться в яєчниках та печінці, шкірі риб Tetradontidae й тритонів Taricha torosa, діючи на зовнішню поверхню мембрани й блокує виникнення ПД у нервах та скелетних м'язів. Токсичність: • Тетродотоксин концентрується в шкірі, гонадах, печінці; • Механізм дії – зв'язується з потенціалзалежними Na+-каналами і блокує Na+- струм.
Клініка: • Відповідь від 15 хв до 12 год; • Оніміння губ, язика, кінцівок; • Легенева недостатність, серцева аритмія; • Летальність – кома; • Відновлення 4/5 днів; ГОНОТОКСИН Токсичність: • Na+-канали, N-, P- & Q-type Сa2+-каналами. МІСЦЕВІ АНАСТЕТИКИ Модифікуюча дія місцевих анестетиків на Na+-канали: ² Вони зв'язуються з гідрофобним локусом рецептора канального білка, і забезпечують інактивацію. ² Місцеві анестетики (третинні аміни) використовують в клініці, оскільки механізм полягає у протонування аміногрупи і переходу молекули в заряджений стан. ЛІДОКАЇН • Механізм дії – дозозалежно зв'язується з потенціалзалежними Na+-каналами і блокує Na+- струм; • Блокує тільки відкриті канали; • У високій дозі блокує провідність мембрани; • У дуже високій дозі блокує також і потенціалзалежні К+-канал. 6)Потенціалзалежні Са2+-канали Надходження іонів кальцію у клітину відбувається за допомогою Са2+-каналів. Розрізняють 2 класи цих каналів: v Потенціалзалежні (контролюються зміною потенціалу); виявлено у ПМ всіх збудливих клітин, зокрема, серцевого, гладкого та скелетногго мязів, ендокринних клітинах, нервових клітинах. v Рецепторкеровані (контролюються мембранними рецепторами, які взаємодіють переважно з нейромедіаторами). Найповнішу інформацію про спроможність двовалентних катіонів переносити вхідний струм в м'язових волокнах ракоподібних отримано С. Хагіварою на м'язах морського жолудя Balanus nubilis. Згідно розрахунків підвищення концентрації іонів кальцію, узгоджується з розрахунком кальцієвого рівноважного потенціалу за формулою Нернста:
де ЕCa– рівноважний потенціал для іонів кальцію; С. Хагівара та К. Такахаші припустили, що важливим проміжним етапом у механізмі проникнення іонів кальцію через мембрану є їх звязування з певною структурою Са2+-каналу, що схематично можна зобразити так:
де Х– місце зв'язування кальцію; Са2+ о, Са2+ і – іони кальцію, що перебувають поза й усередині клітини.
Через Са2+-канал легко проходять та генерують струм інші двовалентні катіони Са2+ > Sr2+ > Ba2+ 1,0: 1,05:1,13 КЛАСИФІКАЦІЯ Сa2+-КАНАЛІВ С.Хагівара (1975) з співробітниками зареєстрували різні кальцієві струми на яйцеклітинах морської зірки. Подальші дослідження на нейронах проведені С. Федулою й П.Г. Костюком (1983), Е. Карбоне та Г. Люксом (1984) показали, що потенціалзалежні Са2+-канали: þ низькопорогові (належить Т-тип, які швидко інактивуються); þ високопорогові (розрізняють L (скелетні, серцеві м'язи, нервові клітини), N, P, Q, R –типи котрі володіють високою специфічністю до певних блокаторів та токсинів. БУДОВА Сa2+-КАНАЛІВ Головна субодиниця α1 є структурним аналогом α-субодиниці Na+-каналу. Са2+-канали в нервових клітинах асоційовані з α2 та δ-субодиницями, які формують зв'язаний дисульфідом трансмембранний глікопротеїновий комплекс, а β-субодиниця є внутрішньоклітинною частиною каналу. Са2+-канали скелетних м'язів мають трансмембранну γ-субодиницю. Існує значна кількість органічних блокаторів кальцієвих каналів, які широко використовуються в клініці як антиаритмічні й судинорозширювальні засоби. Найбільш поширеними блокаторами є фенілалкаламін (верапаміл і його похідне Д-600 – зв'язується з S6 сегментом), дильтіазем і ніфедипін Сa2+-КАНАЛИ та НЕОРГАНІЧНІ ІОНИ С.Хагівара та К. Такахаші встановили, що двовалентні іони, а також іони La3+ пригнічують струми які течуть по Са2+-каналах. В основі такої дії лежить конкурентне звязування Са2+-каналу з цими іонами. Іони Cd2+, Mn2+, Co2+, Ni2+ використовують як специфічні блокатори Т-типу Са2+-каналів. Вивчаючи властивості Са2+-каналів нейронів молюсків П. Костюк та О. Кришталь виявили, що у безкальцієвому розчині за присутності ЕГТА або ЕДТА відбувається модифікація цих каналів. Регуляція високопорогових Са2+-каналів фосфорилюванням та вторинними посередниками. Встановлено що адреналін та норадреналін в міокарді ссавців та амфібій підсилюють кальцієвий струм, взаємодіючи з β-адренорецепторами (метаботропні рецептори). Ефект опосередковано ГТФ-зв'язувальним Gs-білком, що активує аденілатциклазу, що призводить до внутрішньоклітинного підвищення цАМФ. Активація рецепторів нейромедіаторів модулює активність Са2+-каналів за допомогою фосфорилювання через протеїнкінази А та С. 7) Властивості та будова К+-каналів К+-канали – це велика група макромолекул, що формують пори, які переважно є проникними для К+. При вивченні вибірковості К+-каналів у перехватах Ранв”є мієлінізованих нервових волокон жаби для одновалентних катіонів Хілле встановив таку послідовність проникності: Tl+ > K+ > Rb+ > NH4+ 2,3: 1,0: 0,92: 0,13
Провідність К+-каналів, як і натрієвих, блокується за зниження рН зовнішнього розчину, внаслідок протонування кислотної групи, що перебуває в каналі. БУДОВА К+-КАНАЛІВ На підставі іонної вибірковості зроблено пипущення, що діаметр (селективний фільтр – на рисунку зліва – чорний) вузької частини К+-каналу дорівнює 0,3 нм і вона є проникною для іонів з кристалічним діаметром від 0,26 нм (К+) до 0,296 нм (Rb+, NH4+). Через неї не можуть пройти як більші іони (Cs+-0,33 нм, TEA - 0,8 нм) так і менші (Na+- 0,19 нм, Li+ - 0,14 нм). Це пов'язано з тим, що іон який проходить через пору повинен втратити гідратну оболонку, а це можливо тоді коли дегідратований іон взаємодіяти з стінками пори, де розміщені 5 атомів кисню, що належать карбонільним групам. Білок сладається з однієї послідовності S1-S6 - це складні гетероолігомерні білки, утворені 4 α-субодиницями, що формують головну частину каналу та допоміжними β-субодиницями, які прилягають до цитоплазматичної поверхні α-субодиниці і модифікують ворітні процеси. При клонуванні α-субодиниці потенціалзалежного К+-каналу встановлено, що на кількість аміноксилот припадає приблизно одна четверть їхньої кількості у Na+-каналу.
К+-канали витоку (KCNK) сформовані з двох Р-доменів і 4 трансмембранних сегментів, пора каналу сформована двома мономерами, регулюють функціонування гангліїв вісцеральної системи, міокардіоцитів. К+-канали вхідного випрямлення (Kir); АТФ-чутливі К+-канали (КАТР-канали) КЛАСИФІКАЦІЯ К+-КАНАЛІВ На нейронах молюсків вперше ідентифіковано “швидкі” потенціалзалежні К+-канали або А-канали (С. Хагівара, 1961; Ч. Стівенс, 1971). У багатьох типах клітин збільшення концентрації іонізованого кальцію в цитоплазмі призводить до активації калієвої провідності, цей феномен виявлено Дж. Гардосом (1958) на еритроцитах і зумовлений Са2+-активованими К+-каналами (КСа-канали): þ великі КСа-канали виявлено у клітинах гладеньких м'язів, нервових вузлів, хромафінних клітинах, вони активуються деполяризацією мембрани, блокуються токсинами які містяться в отруті скорпіонів; þ малі КСа-канали виявлено у мембрані еритроцитів, в ацинарних клітинах підшлункової залози, у соматичній мембрані нейронів молюсків, провідність їх не перевищує 50 пСм, отрута бджоли апамін блокує ці канали, вони можуть бути як потенціалзалежними так і потенціалнезалежними; Блокатори К+-каналів????????????
ЛЕКЦІЯ №9 на тему: ІОННІ КАНАЛИ ТА 1) Типи регуляції іонних каналів; 2) Поверхневий потенціал клітини; 3) Мембранний потенціал; 4) Потенціал дії та його види; 5) Поширення ПД. Кабельна теорія; 6) Воротні струми іонних каналів; Типи регуляції іонних каналів КАНАЛЬНІ БІЛКИ Канальні білки в залежності від типу стимулу поділяють на: - Потенціалкеровані (потенціалзалежні) – регулюються зміною мембранного потенціалу; - Механочутливі - регулюються зміною мембранного натягу; - Лігандкеровані – вплив певних хімічних сполук; розділяють на опосередковані та безпосередні. Іонні канали відкриваються у відповідь на різний стимул. Ключем механізму до регуляції є потенціал, ліганд та механічний натяг мембрани. Іонні канали є іонселективними Конформаційні зміни канальних білків (ворітні механізми) переводять із закритого стану у відкритий.
Іонні канали мають ворота Вони також Можуть інактивуватися Iнактивація може проходити декількома механізмами ТИПИ іонних каналів: ü Прості пори (GA, GAP junctions) ü Ліганд-керовані канали (Nicotinic receptor) ü Потенціал-залежні канали (K-channels) ü Помпи (ATP-synthase, Na+, K+- ATPase) РОДИНИ КАНАЛІВ Ú Потенціал-залежні Ú Ліганд-керовані (Extracellular та Intracellular) Ú Вхідного виправлення Ú Міжклітинні Ú Інші ПОТЕНЦІАЛ-ЗАЛЕЖНІ Ú Na+ (sodium): I, II, III, µ1, H1, PN3 Ú K+ (potassium): KA, Kv (1-5), Kv(r), Kv(s),KSR, BKCa, IKCa, SKCa, KM, KACh Ú Ca2+ (calcium): L, N, P, Q, T Ú Cl- (chloride): ClC-0 - ClC-8 ЛІГАНД-КЕРОВАНІ Extracellular ligand-gated
Ú nicotinic ACh (muscle): a2dgb (embryonic), a2deb (adult) Ú nicotinic ACh (neuronal): a(2-10), b(2-4) Ú glutamate: NMDA, kainate, AMPA Ú P2X (ATP) Ú 5-HT3 Ú GABAA: a(1-6), b(1-4), g (1-4), d, e, r(1-3) Ú Glycine ЛІГАНД-КЕРОВАНІ (Intracellular ligand-gated) Ú leukotriene C4-gated Ca2+ Ú ryanodine receptor Ca2+ Ú IP3-gated Ca2+ Ú IP4-gated Ca2+ Ú Ca2+-gated K+ Ú Ca2+-gated non-selective cation ВХІДНОГО ВИПРАВЛЕННЯ Ú Kir – 1.1-1.3 – 2.1-2.4 – 3.1-3.5 – 4.1-4.2 – 5.1 – 6.1-6.2 – 7.1 МІЖКЛІТИННІ Ú Канали щілинних контактів – Cx26 – Cx32 – Cx37 – Cx40 – Cx43 – Cx45 – Cx50 – Cx56 ІНШІ Ú Механочутливі Ú Мітохондріальні Ú Ядерні Ú Аквапорини Ú Везикулярні (synaptophysin)
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 611; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.235.141 (0.015 с.) |


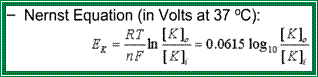


 Підвищення концентрації іонів кальцію у зовнішньому середовищі зумовлює збільшення вхідного кальцієвого струму:
Підвищення концентрації іонів кальцію у зовнішньому середовищі зумовлює збільшення вхідного кальцієвого струму:


