
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рабочая тетрадь для лабораторныхСодержание книги
Поиск на нашем сайте
ХИМИЯ
РАБОЧАЯ ТЕТРАДЬ ДЛЯ ЛАБОРАТОРНЫХ РАБОТ ПО ХИМИИ
Красноярск 2004 УДК 546/(076.1) Г52
Химия: Рабочая тетрадь по лабораторным работам для студентов всех специальностей / Сост. Н. Я. Гладкова, Е. В. Грачева, Л. В. Фоменко. Красноярск: ИПЦ КГТУ, 2002 49 с.
Рекомендуется студентам заочного факультета, обучающимся по дистанционным технологиям.
Печатается по решению Редакционно-издательского совета университета
© КГТУ, 2002
Лабораторная работа № 1 РАСТВОРЫ, СПОСОБЫ ВЫРАЖЕНИЯ ИХ КОНЦЕНТРАЦИИ
ОПЫТ 1. Приготовление серной кислоты заданной концентрации.
Расчет количества серной кислоты, необходимой для приготовления 100 мл 0,1н. раствора H2SO4 из 9% раствора H2SO4 с плотностью В 1л. однонормального (1н.) раствора содержится один эквивалент вещества. mэ (H2SO4) = Для приготовления 100 мл раствора потребуется соответственно 0,01 эквивалент H2SO4, что составит _________г. Расчет массы 9%-ного раствора H2SO4, содержащейся в _______г. безводной H2SO4. В 100 г. 9% раствора H2SO4 содержится _________ г H2SO4,
в Х г. 9% раствора H2SO4 содержится ___________ г H2SO4.
Х = –––––––––––––– = г. H2SO4. (Масса 9%-ной серной кислоты).
Расчет объема H2SO4,который необходимо отмерить пипеткой для проведения опыта:
V =
ОПЫТ 2. Проверка концентрации приготовленной кислоты.
Проверку соответствия концентрации приготовленного раствора значе–нию 0,1н проводят методом титрованя, в основе которого лежит закон экви–валентов: ––––––– = ––––––– = ––––––––––––.
Концентрация приготовленной кислоты определяется по реакции нейтрализации.
H2SO4 + 2NaOH = 2H2O + Na2SO4.
Точку эквивалентности устанавливают с помощью индикатора метило–вого-оранжевого. В кислой среде он имеет ____________________окраши–вание, а в щелочной _______________________.
Таблица результатов титрования Таблица 1.1
Расчет концентрации приготовленного раствора серной кислоты по формуле:
Ск × Vк = Сщ × Vщ, отсюда Ск = ––––––––––––– = ––––––––––––– = н.
Расчет титра приготовленного раствора по формуле:
Т = ––––––––––––––––––– = –––––––––––––––––––– = г/мл.
Расчет относительной ошибки опыта в %:
C = –––––––––––––– × 100 = %.
Дата выполнения работы ______________________________
Подпись преподавателя _______________________________
Лабораторная работа № 2 ЖЕСТКОСТЬ ВОДЫ И МЕТОДЫ ЕЕ УМЯГЧЕНИЯ
ОПЫТ № 1. Определение временной жесткости воды.
Уравнение для определения жесткости воды титрованием раствором
HСl: ___________________________________________________________.
Таблица результатов опытов Таблица 2.1
Цвет индикатора метилового-оранжевого до титрования ____________________, после титрования __________________.
Расчет величины временной жесткости по формуле:
Жвр. = ––––––––––––––––––– = ––––––––––––––––– = мэкв/л. (1)
ОПЫТ 2. Определение общей жесткости воды комплексонометрическим методом.
Таблица результатов опытов Таблица 2.2
Цвет индикатора трилона Б до титрования _________________________, после титрования ________________________.
Расчет величины общей жесткости воды по формуле:
Жобщ. = –––––––––––––––––––– = ––––––––––––––– = мэкв/л. (2)
ОПЫТ 3. Устранение временной жесткости и определение постоянной.
Реакция устранения временной жесткости воды кипячением:
Ca(HCO3)2
Расчет величины постоянной жесткости титрованием трилоном Б по формуле I:
Жпост. = –––––––––––––––– = ––––––––––––––––––– = мэкв/л (3)
Расчет величины временной жесткости воды по формуле:
Жвр.. = Жобщ. (2) – Жпост. (3) = = мэкв/л (4)
Сравнение результаты Жвр., рассчитанной по формулам (1) и (4):
ОПЫТ 4. Умягчение воды катионированием.
Реакции протекающие на катионите в ионообменных колонках при пропускании через них воды:
Расчет жесткости воды титрованием трилоном Б после пропускания через колонку с катионитом:
Ж = –––––––––––––– = ––––––––––––––––––– = мэкв/л.
Вывод: после пропускания воды через колонку с катионитом жесткость воды ____________________________________.
Дата выполнения работы ______________________________
Подпись преподавателя ________________________________
Лабораторная работа № 3 Лабораторная работа № 4 ГИДРОЛИЗ СОЛЕЙ
ОПЫТ 1. Определение реакции среды различных солей с помощью универсального индикатора.
Результаты опытов по определению реакции среды растворов солей.
Таблица 4.1
Уравнения реакций гидролиза солей в молекулярной (1) и ионной (2) формах:
1.а) Na2CO3 + H2O =
б)
2.а) Al2(SO4)3 + H2O =
б)
3.а) (NH4)2CO3 + H2O =
б)
4.а) CH3COONa + H2O =
б)
Вывод: раствор соли KCl гидролизу ____________________________, так как эта соль образована _________________________________________.
При гидролизе карбоната натрия углекислый газ не выделяется, так как _________________________________________________________________.
ОПЫТ 2. Влияние температуры на степень гидролиза.
А.а) CH3COONa + фенолфталеин. Цвет раствора ___________________.
б) CH3COONa + фенолфталеин + нагрев. Цвет раствора____________.
Уравнение реакции гидролиза в молекулярной (1) и ионной (2) формах:
1) CH3COONa + H2O =
2)
Вывод: при нагревании раствора интенсивность окраски _____________, так как_________________________________________________.
Б. Уравнение реакции в молекулярной форме:
Al2(SO4)3 + CH3COONa =
Уравнения реакции гидролиза образующейся соли в молекулярной (1) и ионной (2) формах:
1)
2)
Вывод: появление осадка ___________, обусловлено __________ _________________________________________________________________.
ОПЫТ 3. Влияние разбавление раствора на степень гидролиза.
Уравнения реакций в молекулярной (1) и ионной (2) формах:
1.SnCl2 + H2O =
2.
Выпадает осадок ____________.
1. SnOHCl + HСl(к) =
2.
При подкислении концентрированной HCl осадок растворяется.
Вывод: согласно принципу Ле Шателье при разбавлении раствора и добавлении концентрированной HСl гидролиз _________________________.
ОПЫТ 4. Влияние силы кислоты и основания, образующих соль на степень ее гидролиза.
I пробирка: Na2SO3 + фенолфталеин. Цвет _________________________.
II пробирка: Na2CO3 + фенолфталеин. Цвет ________________________.
Кд (H2CO3) по I ступени = 4,5 × 10–7
Кд(H2SO3) по I cтупени = 1,7 × 10–2.
Вывод: интенсивность окраски в I-й пробирке ________________,чем во II-й. Это можно объяснить __________________________________________.
Уравнения гидролиза в молекулярной (1) и ионной (2) формах:
1. Na2SO3 + H2O =
2.
ОПЫТ 5. Полный (необратимый) гидролиз.
Реакция взаимодействия солей в молекулярной форме:
Al2(SO3)3 + Na2CO3 =
Уравнения гидролиза соли, которая подвергается полному гидролизу в молекулярной (1) и ионной (2) формах:
1.
2.
Выделяется ____________________ газ и выпадает осадок ___________.
Вывод: при реакции не образуется карбонат алюминия, так как. __________________________________________________________________________________________________________________________________.
Дата выполнения работы _________________________________
Подпись преподавателя ___________________________________
Лабораторная работа № 5 Лабораторная работа № 6 Лабораторная № 7 Лабораторная работа № 8 Лабораторная работа №9 ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
ОПЫТ 1. Составление медно-цинкового элемента.
Рис. 9.1. Гальванический элемент Даниэля-Якоби: 1 - растворы ZnSO4 и CuSO4; 2 - электролитический мостик; 3 - гальванометр
Электрохимическая схема медно-цинкового гальванического элемента:
Анодом является пластина ____________, катодом – пластина ________
Электронные уравнения электродных процессов:
Анод (–) Процесс ______________________,
Катод (+) Процесс ______________________.
Уравнение химической реакции, протекающей в гальваническом элементе:
В ионной форме –
В молекулярной форме –
Расчет ЭДС гальванического элемента по формуле:
ЭДС = Е0катода – Е0анода = Е0Cu2+/Cu – E0Zn2+/Zn.
Значения стандартных потенциалов анода и катода выпишите из ряда стандартных электродных потенциалов металлов (рад напряжений):
Е0Zn2+/Zn = ___________ Е0Cu2+/Cu = _____________.
ЭДС =
Алюминий-цинковый гальванический элемент.
Электрохимическая схема алюминий-цинкового гальванического элемента:
Анодом является пластина ____________, катодом – пластина ________.
Электронные уравнения электродных процессов:
Анод (–) Процесс ______________________,
Катод (+) Процесс ______________________.
Уравнение химической реакции, протекающей в гальваническом элементе:
В ионной форме –
В молекулярной форме –
Расчет ЭДС гальванического элемента по формуле:
ЭДС = Е0катода – Е0анода = E0Zn2+/Zn – E0Al3+/Al. Значения стандартных потенциалов анода и катода из ряда стандартных электродных потенциалов металлов (рад напряжений):
Е0Al3+/Al = ___________, Е0Zn2+/Zn = _____________.
ЭДС =
ОПЫТ 2. Составление концентрационного гальванического элемента
Электрохимическая схема концентрационного гальванического элемента:
(–) Анод Zn ½ ZnSO4 ½½ ZnSO4 ½ Zn Катод (+) 0,01М 1М
Электронные уравнения электродных процессов:
Анод (–) Процесс _____________________,
Катод (+) Процесс ______________________.
Расчет электродного потенциала по уравнению Нернста.
EZn2+/Zn (анода) = E0Zn2+/Zn +0,059/n × lg [Zn2+] =
EZn2+/Zn (катода) = E0Zn2+/Zn =
Расчет ЭДС концентрационного гальванического элемента по формуле:
ЭДСкгэ = EZn2+/Zn (катода) – EZn2+/Zn (анода) =
ОПЫТ 3. Изготовление свинцового аккумулятора
Рис. 9.2. Свинцовый аккумулятор:
1 - широкогорлая склянка, 2 - пробка, 3 - пластины из свинцовой фольги, 4 - отверстие для выхода газа, 5 - проводники, 6 - фильтровальная бумага
При зарядке аккумулятора электрическая энергия превращается в химическую. Протекающие при этом химические процессы выражаются ионными уравнениями: на катоде: Катод (-) PbSO4 + 2 Pb2+ + 2
на аноде: Анод (+) Pb2SO4 - 2 Pb2+ - 2
Суммируя эти одновременно протекающие процессы, получим уравнение химической реакции, протекающей при зарядке аккумулятора:
2PbSO4 + 2H2O = Pb + PbO2 + 4H+ + 2SO42-.
Заряженный аккумулятор представляет собой гальванический элемент, работающий на основе самопроизвольно протекающего окислительно-восстановительного процесса:
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O.
При разрядке аккумулятора химическая энергия превращается в элект-рическую,. Электродные процессы выражаются уравнениями: на катоде: Катод (+) PbO2 + 2 Pb4+ + 2
на аноде: Анод (-) Pb0 - 2 Pb0 - 2
Дата выполнения работы ___________________________,
Подпись преподавателя ____________________________.
Лабораторная работа №10 Лабораторная работа №11 Лабораторная работа №12 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
ОПЫТ 1. Образование и диссоциация соединений с комплексным анионом.
Уравнения реакций образования K[BiJ4] в молекулярной форме:
1.Bi(NO3)3 + KJ ® BiJ3¯ +
2. BiJ3 + KJ ®
в ионной форме:
1.
2.
Цвет осадка BiJ3 _____________, цвет полученного раствора K[BiJ4] __________________ за счет присутствия иона ________________.
В полученном комплексном соединении K[BiJ4] – тетраиодовисмутате калия комплексообразователем является ________, лигандами – ионы ______. Уравнения электролитической диссоциации K[BiJ4]:
1 ступень диссоциации – K[BiJ4] ®
2 ступень диссоциации –
Выражение для константы нестойкости комплексного аниона:
Кн = –––––––––––––––––––––––––.
ОПЫТ 2. Образование и диссоциация соединений с комплексным катионом.
Молекулярные уравнения образования осадков гидроксидов:
1. NiSO4 + NH4OH ® Ni(OH)2¯ +
2. ZnSO4 + NH4OH ® Zn(OH)2¯ +
3. CuSO4 + NH4OH ® Cu(OH)2¯ +
Уравнения реакций в сокращенной ионной форме:
1. __________________________________________________,
2. __________________________________________________,
3. __________________________________________________.
Молекулярные уравнения растворения гидроксидов и образования комплексных оснований, содержащих комплексный катион:
1. Ni(OH)2¯+ NH4OH ® [Ni(NH3)6](OH)2 +
2. Zn(OH)2¯+ NH4OH ® [Zn(NH3)4](OH)2 +
3. Cu(OH)2¯+ NH4OH ® [Cu(NH3)4](OH)2 +
Цвет осадков гидроксидов и комплексных катионов полученных комплексных соединений:
1. Ni(OH)2¯_________________ [Ni(NH3)6]2+ ______________________,
2. Zn(OH)2¯_________________ [Zn(NH3)4]2+ ______________________,
2. Cu(OH)2¯ ________________ [Cu(NH3)4]2+ ______________________.
Уравнения электролитической диссоциации комплексных оснований.
1 ступень диссоциации:
1. [Ni(NH3)6](OH)2 ®
2. [Zn(NH3)4](OH)2 ®
3. [Cu(NH3)4](OH)2 ®
2 ступень диссоциации:
1. [Ni(NH3)6]2+ ®
2. [Zn(NH3)4]2+ ®
3. [Cu(NH3)4]2+ ®
Выражения для констант нестойкости комплексных катионов:
К1 = ––––––––––––––––––––––––––––,
К2 = ––––––––––––––––––––––––––––,
К3 = ––––––––––––––––––––––––––––.
ОПЫТ 3. Образование соединения, содержащего комплексный катион и анион.
Уравнение реакции образования осадка гексацианоферрата (II) никеля:
K4[Fe(CN)6] + NiSO4 ® Ni2[Fe(CN)6]¯ +
Уравнение реакции растворения образовавшегося осадка гексациано- феррата (II) никеля в 25%-ном растворе аммиака:
Ni2[Fe(CN)6]¯ + NH4OH ® [Ni(NH3)6]2[Fe(CN)6]¯ +
ОПЫТ 4. Обменная реакция гексацианоферрата (II) калия с солью меди
Уравнение реакции образования гексацианоферрата (II) меди:
K4[Fe(CN)6] + CuSO4 ® Cu2[Fe(CN)6]¯ +
Цвет образовавшегося осадка Cu2[Fe(CN)6]¯ _________________.
ОПЫТ 5. Различие между простыми и комплексными ионами железа
А. Уравнение качественной реакции на ион Fe3+.
Молекулярное уравнение:
FeCl3 + KCNS ®
Б. Исследование раствора K3[Fe(CN)6] на присутствие ионов Fe3+.
K3[Fe(CN)6] + KCNS ®
Раствор __________________ цвет. Следовательно ион ______ в растворе
K3[Fe(CN)6] _____________________________.
В. Качественная реакция на комплексный ион [Fe(CN)6]3–.
Первая пробирка:
FeCl3 + FeSO4 ®
Окраска раствора _______________________, так как в нем ____________________ ион [Fe(CN)6]3–.
Вторая пробирка:
K3[Fe(CN)6] + FeSO4 ® Fe3[Fe(CN)6]2¯ +
Образовался осадок __________________________. Это качественная реакция на комплексный ион _______________.
ОПЫТ 6. Диссоциация двойных и комплексных солей
А. Диссоциация в растворе соли Мора:
(NH4)2SO4 × FeSO4 × 6H2O = 2NH4+ + 2SO42– + Fe2+ + 6 H2O.
Молекулярные уравнения качественных реакций на ионы:
1. FeSO4 + (NH4)2S ® FeS¯ +
2. FeSO4 + BaCl2 ® BaSO4¯ +
3. (NH4)2SO4 + NaOH ® NH3 + H2O +
Краткие ионные уравнения качественных реакций:
1.
2.
3. Эти реакции указывают на присутствие в растворе соли Мора следующих ионов:
1. ионов __________, 2. ионов ____________, 3. ионов ____________.
Б. Диссоциация в растворе гексацианоферрата (II) калия:
K4[Fe(CN)6] ® 4K+ +[Fe(CN)6]4–.
При добавлении в пробирку с раствором K4[Fe(CN)6] раствора (NH4)2S черный осадок ___________________, следовательно ион _______ в растворе _____________________.
Процессы диссоциации двойных и комплексных солей отличаются ______________________________________________________________________________________________________________________________________________________________________________________________________
Дата выполнения работы ________________________.
Подпись преподавателя _________________________.
СОДЕРЖАНИЕ
Лабораторная работа № 1. 3 РАСТВОРЫ, СПОСОБЫ ВЫРАЖЕНИЯ ИХ КОНЦЕНТРАЦИИ.. 3 Лабораторная работа № 2. 4 ЖЕСТКОСТЬ ВОДЫ И МЕТОДЫ ЕЕ УМЯГЧЕНИЯ.. 4 Лабораторная работа № 3. 6 ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.. 6 Лабораторная работа № 4. 10 ГИДРОЛИЗ СОЛЕЙ.. 10 Лабораторная работа № 5. 13 ТЕПЛОВЫЕ ЭФФЕКТЫ И НАПРАВЛЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ.. 13 Лабораторная работа № 6. 18 ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ. 18 Лабораторная № 7. 21 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.. 21 Лабораторная работа № 8. 26 ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ.. 26 Лабораторная работа №9. 32 ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.. 32 Лабораторная работа №10. 36 ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ СОЕДИНЕНИЙ.. 36 Лабораторная работа №11. 39 КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА ОТ НЕЕ. 39 Лабораторная работа №12. 44 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.. 44
ХИМИЯ
РАБОЧАЯ ТЕТРАДЬ ДЛЯ ЛАБОРАТОРНЫХ РАБОТ ПО ХИМИИ
Красноярск 2004 УДК 546/(076.1) Г52
Химия: Рабочая тетрадь по лабораторным работам для студентов всех специальностей / Сост. Н. Я. Гладкова, Е. В. Грачева, Л. В. Фоменко. Красноярск: ИПЦ КГТУ, 2002 49 с.
Рекомендуется студентам заочного факультета, обучающимся по дистанционным технологиям.
Печатается по решению Редакционно-издательского совета университета
© КГТУ, 2002
Лабораторная работа № 1
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 214; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.108.48 (0.012 с.) |

 =1,059 г/см3.
=1,059 г/см3.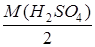 = –––––––– = г/моль.
= –––––––– = г/моль. = ––––––– = мл.
= ––––––– = мл.


 = Pb0 + SO42-, или
= Pb0 + SO42-, или


