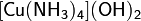Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классы неорганических соединенийСодержание книги
Поиск на нашем сайте
Оксиды – соединения элемента с кислородом, имеющим степень окисления –2 (Например CaO). Оксиды не образующие кислот, оснований и солей при обычных условиях, называются не солеобразующими. Основания – сложные вещества, молекулы которых состоят из атома металла (или иона NH4+) и одной или нескольких гидроксогрупп ОН, способных замещаться на кислотный остаток (Например KOH). Кислоты – сложные вещества, содержащие атомы водорода, которые могут замещаться катионами металла (или ионами аммония) (Например HCl). Соли – продукты замещения (полного или частичного) атомов водорода в молекулах кислот катионами металла (а также ионами аммония), либо гидроксогрупп в молекулах оснований кислотными остатками. Кислые соли – это продукт не полного замещения атомов водорода в молекулах только многоосновных кислот (K2HPO4). Основные соли – продукт неполного замещения гидроксогрупп в молекулах только многокислотных оснований кислотными остатками ((CuOH)2CO3) Двойные соли – содержит два химически разных катиона и один тип аниона (KAl(SO4)2 * 12H2O) Смешанные соли – содержат один тип катиона, но два типа аниона (Ca(OCl)Cl). Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: Комплексные соли — в их состав входит комплексный катион или комплексный анион. Пример: Номенклатура неорганических соединений Основой номенклатуры неорганических соединений служат названия химических элементов. Как правило, название соединения состоит из двух слов. Одно из них означает принадлежность данного соединения к определённому роду (или классу), другое — к определённому виду. Например, в названии «серная кислота» существительное показывает, что данное вещество относится к кислотам, а прилагательное поясняет, что это кислота, образованная серой в высшей степени окисления. Название «сульфат натрия» говорит, что вещество принадлежит к сульфатам (солям серной кислоты) и представляет собой соль натрия.
! Номенклатура неорганических соединений огромная, не думаю, что надо её будет в билете всю рассказывать, но если что, вот номенклатура солей, даю её, потому что она самая интересная! Разберем номенклатуру солей, так как она самая интересная в неорганических соединений
2. Динамический характер химического равновесия Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются. Зависимость скорости реакции от природы веществ, их концентрации и температуры Скорость химических реакций зависит от природы реагирующих веществ. В качестве примера можно привести реакций окисления серебра кислородом и озоном: первая идет медленно, вторая протекает почти мгновенно. Ag + O2 = Ag2O Ag + O3 = Ag2O + O2 Как правило, увеличение концентрации или давления (для реакций с участием газов) реагентов приводит к повышению скорости реакции. С ростом температуры увеличивается частота столкновений молекул реагирующих веществ, а следовательно, скорость реакций. При понижении – скорость уменьшается. 3. 2KMnO4 + 3K2SO3 + H2O = 3K2SO4 + 2MnO2 + 2KOH K2S+CH3COOH = 2CH3COOK + H2S
№23 1. Порядок заполнения орбиталей многоэлектронных атомов В невозбужденном атоме все электроны обладают наименьшей энергией (принцип наименьшей энергии). Принцип Паули В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином). Правило Хунда При данном значении квантового числа 1 (т.е. в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов.
S-, p-, d-, f- элементы В зависимости от состояния электронов в атомах различают s-, p-, d-, f-орбитали и соответствующие им s-, p-, d-, f-подуровни. В зависимости от того, какой подуровень (s, p, d или f) заполняет очередной электрон, соответственно различают s-, p-, d- или f-элементы. В главных подгруппах ПСХЭ Д.И.Менделеева находятся s- и р-элементы, а в побочных подгруппах – d- и 2. Равновесие в насыщенных растворах малорастворимых электролитов (солей) <---- твердая раствор
|
||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 383; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.86.209 (0.011 с.) |

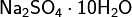 .
.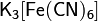 ,
,