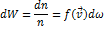Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон Авогадро. Рівняння Клайперона-Менделєєва.Содержание книги
Поиск на нашем сайте
Зако́н А́вогадро — однакові об'єми будь-яких газів при однаковому тиску і температурі містять однакову кількість молекул. Цей закон був відкритий італійським фізиком Амедео Авогадро в 1811 році. Наслідок закону Авогадро: однакові кількості молекул різних газів при однаковій температурі і однаковому тиску займають однакові об'єми. Так як 1 моль будь-яких газів містить однакову кількість молекул — 6,02 • 1023, це число називають сталою Авогадро і позначають NA. Об'єм, який займає один моль будь-якого газу при нормальних умовах, називається молярним об'ємом (позначається Vm). Нормальними (скорочено н. у.) називаються такі умови, коли температура дорівнює 0 °C, а тиск 1 ат., або 760 мм рт. ст. Молярний об'єм усіх газів незалежно від їх маси однаковий і дорівнює 22,4 дм3 (22,4 л). Рівняння стáну ідеального газу(Клапейрона-Менделеєва) — формула, що встановлює залежність між тиском, молярним об'ємом і абсолютною температурою класичного ідеального газу. Рівняння має вигляд:
Швидкості газових молекул та іх вимірювання. Середня, середня квадратична та найбільш імовірна швидкості. Явища молекулярної фізики визначаються у великій мірі швидкостями руху молекул. Швидкості газових молекул внаслідок їхнього хаотичного руху відрізняються як за величиною, так і за напрямом. Швидкість даної молекули газу в даний момент часу є величина випадкова. У молекулярно-кінетичній теорії газів користуються поняттями середньої <v>, середньої квадратичної <vкв. > та найбільш імовірної (vн) швидкостей. Ці швидкості задаються для рівноважних станів газу. Середня (або середньоарифметична) швидкість визначається рівнянням Середня квадратична швидкість визначається з рівняння
За цією формулою можна обчислити також швидкість броунівських частинок. Звичайно, при цьому т0 — маса броунівської частинки. Цьому виразу можна надати більш зручного вигляду, помноживши чисельник і знаменник під коренем на число Авогадро. Враховуючи, що kNA=R та m0NA=M, <vкв>=кор.кв.(3RT/M). Середню квадратичну швидкість називають ще тепловою. тепловий рух досить інтенсивний для молекул, помітний для мікроскопічних частинок, які здійснюють броунівський рух, і зовсім непомітний для тіл великої маси.
Функція розподілу молекул за швидкостями. Розподіл Максвелла. У стані статистичної рівноваги в ідеальному газі, яка настає внаслідок зіткнень молекул між собою, встановлюється розподіл молекул за швидкостями, що не змінюється з часом. Визначити, яким буде цей розподіл — одна із задач статистичної фізики.
Величину f(v) називають функцією розподілу молекул за швидкостями, або інакше, густиною ймовірності розподілу швидкісних точок молекул у просторі швидкостей. Функція f(v) описує лише ймовірний розподіл молекул за швидкостями і змінюється неперервно зі зміною v. Функція розподілу може стосуватися довільної неперервно змінної випадкової величини: швидкості, координати, імпульсу, моменту кількості руху, енергії тощо. Формулу Максвелла, що визначає відносну кількість молекул, швидкості яких лежать у межах v I v+dv, запишемо так:
Розподіл Максвелла має фундаментальне значення для молекулярної теорії газів. Загальну теорію статистичних властивостей фізичних систем розвинули Больцман та Гіббс. Розподіл Максвелла — це перший приклад статистичного закону в науці. Дж. Максвелл усвідомив, що випадковий рух окремих молекул підпорядкований певному статистичному закону. Крива розподілу Максвелла вказує на те, що в газі найбільша частина молекул рухається з швидкостями, значення яких близькі до vн. У законі Максвелла функція розподілу залежить від природи газу та його температури. Розподіл Максвелла передбачає, що на молекули газу не діють зовнішні сили. Тому молекули рівномірно розподілені в певному об’ємі. Фактично молекули газів перебувають під дією поля тяжіння.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 389; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.20.205 (0.005 с.) |