
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рівняння стану ідеального газу. Рівняння Клайперона. Молярна газова стала R. Фізичний зміст.Содержание книги
Поиск на нашем сайте
Рівн́яння стáну ідеáльного гáзу — формула, що встановлює залежність між тиском, молярним об'ємом і абсолютною температурою класичного ідеального газу. Рівняння має вигляд:
p — тиск, Vμ — молярний об'єм, T — абсолютна температура, R — універсальна газова стала. Оскільки
Останнє рівняння називають об'єднаним газовим законом. З нього випливають закони Бойля—Маріотта, Шарля і Гей—Люссака:
Закон Бойля—Маріотта названий на честь ірландського фізика, хіміка і філософа Роберта Бойля (1627—1691), що відкрив його в 1662, а також на честь французького фізика Едма Маріотта (1620—1684), який відкрив цей закон незалежно від Бойля в 1676 році. Якщо записати
Ця форма запису носить назву рівняння (закона) Клапейрона—Менделєєва. Газова стала (рос. газовая постоянная, англ. gas constant, нім. Gaskonstante) - R — фізична стала у рівнянні стану ідеального газу: Універсальна газова стала Універсальна газова R стала визначається співвідношенням
де NA - число Авогадро, kB - стала Больцмана.
Таким чином можна сформулювати фізичний зміст універсальної газової сталої: універсальнагазова стала R чисельно дорівнює роботі ізобарного розширення одного моля ідеального газу під час нагрівання його на 1 К. Закон Бойля-Маріотта. Коефіцієнт стисливості. Зако́н Бо́йля — Маріо́тта — закон ідеальних газів, згідно з яким добуток тиску на об'єм незмінної маси такого газу при сталій температурі є величина стала:
де p — давление газа; V — объём газа У певних межах справедливий для розріджених реальних газів, тобто для природних і нафтових вуглеводневих газів за нормальних (чи стандартних) умов. Тоді його записують так: p0 V0 = pV, де індекс нуль означає ці умови. Закон відкрив у 1682 році Роберт Бойль. Едм Маріотт опублікував його в 1676 році. У термодинімічній діаграмі p — V ізотермічний процес зображаєтсья кривою, що називаєься ізотермою. Коефіцієнт стисливості (надстисливості) газу (рос. коэффициент сжимаемости (сверхсжимаемости) газа; англ. gas compression factor; нім. Realgasfaktor m) — відношення об’ємів реального пластового і ідеального газів при однакових умовах, тобто при одних і тих же самих тиску і температурі. Коефіцієнт стисливості газу вводиться в рівняння Клапейрона-Менделєєва, характеризує ступінь відхилення реальних газів від ідеального стану і є відношенням об’єму реального газу до об’єму, який займала б така ж кількість молів ідеального газу за тих же тиску і температури.
Синоніми - коефіцієнт пружності газу, коефіцієнт об’ємної пружності газу, коефіцієнт пружного розширення газу, коефіцієнт надстисливості газу. Для однокомпонентного газу з молярною масою
де Закон Гей-Люссака. Коефіцієнт об’ємного розширення газу. Зако́н Гей-Люсса́ка — назва двох законів, що описують властивості газів. 1) Закон теплового розширення газів: при сталому тискові залежність об'єму Vt даної маси газу від температури описується формулою: Vt/T = const або Vt=V0(1+ αt), де V0 — об'єм газу при даному тискові і при температурі 273,15 К; t — температура (емпірична) за шкалою Цельсія; Т — термодинамічна температура; α — коефіцієнт об'ємного розширення газу (для інертних газів, водню і кисню а дорівнює коефіцієнту об'ємного розширення ідеального газу α = 1/(273.15 К)). 2) Закон об'ємних відношень, за яким при постійних температурі і тиску об'єми газів, які вступають у реакцію, відносяться між собою і до об'ємів газоподібних продуктів реакції, як невеликіпрості числа. Наприклад, при взаємодії одного об'єму водню з одним об'ємом хлору утворюється два об'єми хлористого водню. Закон носить ім'я французького вченого Жозефа-Луї Гей-Люссака. Коефіцієнт об’ємного розширення газу ------???????
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 121; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.98.100 (0.009 с.) |

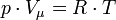 , де:
, де: , де ν — кількість речовини, то рівняння можна записати у вигляді:
, де ν — кількість речовини, то рівняння можна записати у вигляді: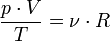

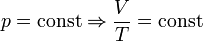 — закон Гей-Люссака
— закон Гей-Люссака — закон Шарля (другий закон Гей-Люссака)
— закон Шарля (другий закон Гей-Люссака)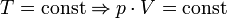 — закон Бойля-Маріотта
— закон Бойля-Маріотта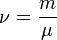 , де m — маса, μ — молярна маса, рівняння стану виглядатиме так:
, де m — маса, μ — молярна маса, рівняння стану виглядатиме так:
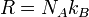 = 8,314472 Дж/(моль•К),
= 8,314472 Дж/(моль•К), .
. , при тиску
, при тиску 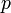 , температурі
, температурі 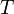 , i густині
, i густині  коефіцієнт стисливості газу визначається за формулою:
коефіцієнт стисливості газу визначається за формулою: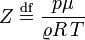
 — універсальна газова стала.
— універсальна газова стала.


