
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Підтвердження молекулярно-кінетичної теорії : Броунівський рух, дифузія, молекулярні пучки.Стр 1 из 2Следующая ⇒ Кінети́чна тео́рія або молекуля́рно-кінети́чна тео́рія — фізична теорія, що пояснює термодинамічні явища, виходячи з атомістських уявлень. Теорія постулює, що тепло є наслідком хаотичного руху надзвичайно великої кількості мікроскопічних частинок (атомів тамолекул). Успішне пояснення багатьох законів термодинаміки, виходячи з положень кінетичної теорії, стало одним із факторів на шляху до підтвердження атомарної будови речовин у природі. В сучасній фізиці молекулярно-кінетична теорія розглядається як складова частина статистичної механіки. Молекулярно-кінетична теорія виходить із того, що речовина, зокрема газ складається з великої кількості мікроскопічних частинок (молекул), які рухаються хаотично. Частинки стикаються між собою та зі стінками посудини, створюючи на ці стінки тиск. Усі зіткнення вважаються пружними, тобто проходять без втрати енергії. Середня кінетична енергія руху частинок залежить від температури. Середня кінетична енергія руху молекули
де m — маса частинки, v — її швидкість, kB — стала Больцмана, T — температура. Середня швидкість частинок у газі дорівнює
де R — газова стала, M — молярна маса. Тиск газу на стінки посудини визначається з того міркування, що при пружньому відбитті частинки від стінки, зміна її імпульсу дорівнює 2 mvx, де vx — перпендикулярна до стінки складова швидкості. Підрахувавши переданий за час Δ t імпульс, і прирівнявши його до імпульсу сили для тиску отримуємо
де n — кількість частинок в одиничному об'ємі.
Бро́унівський рух — невпорядкований, хаотичний рух дрібних частинок речовини в розчинах. Названий на честь ботаніка Роберта Брауна, який спостерігав[1] це явище під мікроскопом у 1827 р.. Теорію броунівського руху побудував у 1905 р. Альберт Ейнштейн. У броунівському русі вражає одна незвична для нас особливість – рух частинок не припиняється за будь-яких обставин, хоча під час дослідження його причин вживалися запобіжні заходи, які виключали можливість зовнішніх впливів на броунівські частинки. Характер їх руху не змінювався. Досліди свідчать, що інтенсивність броунівського руху тим більша, чим вища температура рідини, що ще раз підтверджує безпосередній зв’язок броунівського руху з тепловим рухом молекул. Перша кількісна теорія броунівського руху з’явилася у 1905р. Її автором був Альберт Ейнштейнн. Він записав рівняння, яке враховувало хаотичність сили, що діє на броунівську частинку, й, розв'язавши його, отримав співвідношення
де
Дифу́зія — процес випадкового невпорядкованого переміщення частинок під впливом хаотичних сил, зумовлених тепловим рухом і взаємодією з іншими частками. Дифузія відбувається в газах, рідинах і твердих тілах. Механізм дифузії в цих речовинах істотно різний. Дифузія що відбувається внаслідок теплового руху атомів, молекул, — молекулярна дифузія. Мірою дифузії є маса Δ M речовини, що продифундувало за одиницю часу через одиницю площі поверхі контактних речовин. Величина Δ M тим більша, чим більша зміна концентрації на одиницю довжини вздовж напрямку, у якому проходить дифузія Для опису процесу вирівнювання концентрації часток в термодинамічній системі використовується рівняння дифузії. В загальному випадку воно є наслідком рівняння неперервності, яке визначає закон збереження кількості часток.
де n — концентрація часток, Якщо припустити, що потік часток пропорційний градієнту концентрації з коефіцієнтом пропорційності D,
то отримаємо феноменологічне рівняння дифузії
де В загальному випадку просторово неоднорідних систем часток, які взаємодіють між собою рівняння дифузії записується у вигляді:
де μ — хімічний потенціал. Це рівняння виражає той факт, що умовою рівноваги за складом є рівність хімічного потенціалу у всій термодинамічній системі, а вирівнювання концентрації — це лише частковий випадок для однорідних систем, близьких до ідеального газу. Молекулярні і атомні пучки - направлені потоки молекул або атомів, рухомих у вакуумі практично без зіткнень один з одним і з молекулами залишкових газів. М. і а. п. дозволяють вивчати властивості окремих часток, нехтуючи ефектами, обумовленими зіткненнями, окрім тих випадків, коли самі зіткнення є об'єктом досліджень.
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 91; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.25.74 (0.003 с.) |
 ,
, ,
, ,
,
 - середнє значення квадрата зміщення броунівської частинки вздовж осі Х за час t, Т - абсолютна температура рідини, b - коефіцієнт пропорційності, який залежить від розмірів броунівських частинок і в’язкості рідини, а NA – універсальна фізична константа, число Авогадро.
- середнє значення квадрата зміщення броунівської частинки вздовж осі Х за час t, Т - абсолютна температура рідини, b - коефіцієнт пропорційності, який залежить від розмірів броунівських частинок і в’язкості рідини, а NA – універсальна фізична константа, число Авогадро.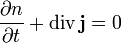 ,
,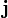 — їхній потік.
— їхній потік. .
.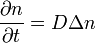 ,
,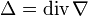 — оператор Лапласа.
— оператор Лапласа. ,
,


