
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Описание метода измерений и установкиСодержание книги Поиск на нашем сайте
Применяемый в этой работе метод определения удельной теплоты плавления олова основан на том, что скорость выделения теплоты при кристаллизации металла должна быть равна скорости теплоотдачи в окружающую среду
где Из формулы (2) имеем:
Так, как в процессе кристаллизации температура металла не изменяется, то скорость теплоотдачи в этот период не может быть изменена непосредственно. Но скорость теплоотдачи при прочих равных условиях зависит только от разности температур между нагретым телом и окружающей средой. Поэтому среднее значение скорости охлаждения до наступления процесса кристаллизации и после него будет приблизительно равно скорости теплоотдачи в период затвердевания. Воспользовавшись этим можем записать:
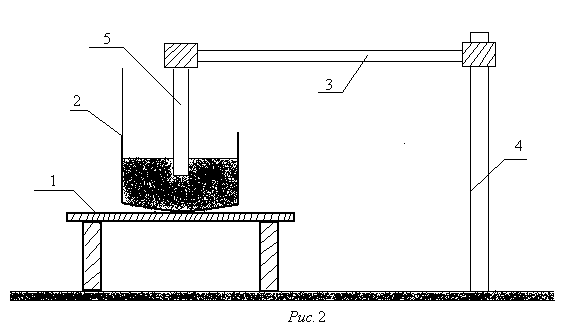
где Следовательно, удельная теплота плавления определяется следующей формулой: Для расплавления олова применяется электроплитка 1 (рис. 2.) с нихромовым нагревателем с мощностью 300 Вт.
Олово в количестве 50 г помещается в фарфоровый тигель 2 емкостью 10 см3. Температура олова измеряется закрепленным в держателе 3 штатива 4 термометром 5.
Порядок выполнения работы 1. Взвешиванием на технических весах определяется масса тигеля и масса олова. 2. Тигель с оловом помещается на электроплитку. Когда олово расплавится в него погружается термометр, и температура доводится до
3. Через каждые 4. По таблице наблюдений строят график зависимости На полученной кривой выбирают два прямолинейных участка
5.Вычислить удельную теплоту плавления олова по формуле (4). Значения 6. Результаты измерений и вычислений записать в таблицу:
7. Окончательный результат измерения записать в виде
Контрольные работы 1. Как представляется плавление тел с точки зрения молекулярно- кинетической теории? 2. Сформулировать первое начало термодинамики. 3. Доказать, что процесс плавления является изотермическим. 4. Дать определение удельной теплоты плавления и вывести единицу ее измерения в 5. Объяснить метод измерения удельной теплоты плавления.
Лабораторная работа 8 Определение приращения энтропии при плавлении олова Цель работы: определение изменение энтропии при известных изменениях температуры и удельной теплоты плавления.
Необходимые приборы и пренадлежности: тигель с оловом; электроплитка, термопара, сосуд с водой, милливольтметр, секундомер.
Теоретическое введение Термодинамической системой называется совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой. Термодинамическая система может находиться в различных состояниях, характеризуемыми температурой, объемом, давлением и т.д. Состояние термодинамической системы будет равновесным, если все параметры состояния имеют определенные значения, не изменяющиеся с течением времени (при постоянных внешних условиях). Состояние системы называется неравновесным, если параметры характеризующие это состояние меняются. Переход системы из одного состояния в другой называется термодинамическим процессом. Обратимым называется такой процесс, в конце которого система возвращается к состоянию, в котором она была в начале процесса так, что в окружающей ее среде не остается никаких изменений. Другими словами, обратимый процесс- это такой процесс, который протекает чрезвычайно медленно, и система возвращается в первоначальное состояние пройдя те равновесные состояния в которых она находилась раньше, только в обратном порядке. Процесс, который не удовлетворяет вышеуказанному условию, называется необратимым процессом. Реальные процессы необратимы. Примером обратимого процесса могло бы служить колебание маятника, если бы оно происходило без трения. В течении одного перехода колебания маятник возратился бы в начальное положение, причем ни в окружающей среде, ни в системе (маятнике) не осталось бы следов от происшедших за этот период изменений. Однако трение неустранимо. Поэтому часть механической энергии системы всегда переходит в теплоту и безвозвратно рассеивается в окружающей среде. Следовательно, механические процессы необратимы. Вообще, в природе нет обратимых процессов. Наглядным примером необратимости реальных процессов являются процессы теплообмена и расширения газа в пустоту. Теплота самопроизвольно переходит от горячего тела к холодному, но обратный самопроизвольный процесс не имеет места, так гласит второе начало термодинамики. Газ самопроизвольно расширяется в пустоту, но обратный процесс- самопроизвольное сжатие не имеет места. Итак, в реальных условиях обратимые процессы неосуществимы. Однако, на практике можно с известным приближением некоторые процессы считать обратимыми. Обычно медленно (в идеальном случае очень медленно) протекающий процесс является обратимым. Отношение теплоты, полученной системой к абсолютной температуре, при которой поисходила эта передача, называется приведенной теплотой
А в пределе для любого обратимого процесса
Подинтегральное выражение
Согласно выражению (3), энтропия – это приведенная величина, характеризующая состояние системы, дифференциал которой равен отношению бесконечного малого количества теплоты, сообщенного системе в элементарном обратимом процессе, к температуре последней. Функция
Из формулы (2) следует, что для обратимых процессов изменение энтропии
В термодинамике доказывается, что энтропия системы совершающей необратимый процесс возрастает
Расчеты показывают, что при повышение температуры энтропия системы возрастает. Поскольку теплоте присуще наиболее беспорядочный характер движения материи (хаотическое движение молекул), то можно указать возрастанию энтропии соответствует увеличению беспорядка (хаоса) в состоянии системы. В этом смысле физический смысл энтропии можно определить как меру беспорядка (хаоса) состояния системы. Соотношение (5) и (6) можно определить в виде неравенства Клаузиуса
т.е. энтропия изолированной системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов). Все реальные процессы являются необратимыми. Поэтому можно утверждать, что все процессы в изолированной системе ведут к увеличению ее энтропии (принцип возрастания энтропии). Вместе с тем неравенство Клаузиуса указывает направление протекания реальных процессов: возможны лишь такие процессы, которые ведут к увеличению энтропии изолированной системы (второе начало термодинамики).
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 162; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.148.63 (0.006 с.) |

 (2)
(2) - удельная теплота плавления;
- удельная теплота плавления;  - масса олова;
- масса олова;  - время процесса кристаллизации;
- время процесса кристаллизации;  - количество тепла отдаваемого в окружающую среду,
- количество тепла отдаваемого в окружающую среду,  - скорость теплоотдачи.
- скорость теплоотдачи. (3)
(3)
 – масса сосуда содержащего исследуемый металл,
– масса сосуда содержащего исследуемый металл,  - удельная теплоемкость сосуда,
- удельная теплоемкость сосуда,  и
и  - удельные теплоемкости жидкого и твердого олова;
- удельные теплоемкости жидкого и твердого олова;  и
и  - скорости охлаждения олова до и после затвердевания.
- скорости охлаждения олова до и после затвердевания. (4)
(4)
 . Затем электроплитка выключается.
. Затем электроплитка выключается.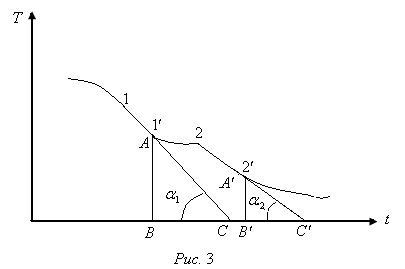
 записываются показания термометра. Измерения прекращаются при охлаждении олова до
записываются показания термометра. Измерения прекращаются при охлаждении олова до  , после чего электроплитка вновь включается и олово расплавляется для извлечения из него термометра.
, после чего электроплитка вновь включается и олово расплавляется для извлечения из него термометра. , откладывая по оси ординат температуру
, откладывая по оси ординат температуру  , а по оси абсцисс-
, а по оси абсцисс-  время (рис.3). По этой кривой графически определяются значения величин
время (рис.3). По этой кривой графически определяются значения величин  и
и  , а также длительность промежутка времени, в течении которого температура олова осталась неизменной.
, а также длительность промежутка времени, в течении которого температура олова осталась неизменной. и
и  . Через выбранные участки проводят касательные к кривой. Длина горизонтального участка кривой дает в выбранном маштабе время отвердения
. Через выбранные участки проводят касательные к кривой. Длина горизонтального участка кривой дает в выбранном маштабе время отвердения  , а тангенсы углов наклонных прямых- средние скорости охлаждения до и после отвердевания
, а тангенсы углов наклонных прямых- средние скорости охлаждения до и после отвердевания  . Для определения
. Для определения 
 и
и  к оси
к оси  опускают перпендикуляры
опускают перпендикуляры  и получают треугольники
и получают треугольники  и
и  (см. Рис.3). Из этих треугольников находят тангенсы углов
(см. Рис.3). Из этих треугольников находят тангенсы углов  и
и  :
: ;
; 
 и
и  считаются заданными.
считаются заданными.









 .
. . В обратимых круговых процессах сумма приведенных теплот равна нулю:
. В обратимых круговых процессах сумма приведенных теплот равна нулю: (1)
(1) (2)
(2) представляет собой полный дифференциал некоторой функции
представляет собой полный дифференциал некоторой функции  , которая зависит только от состояния системы и не зависит от пути, каким система пришла в это состояние. Таким образом:
, которая зависит только от состояния системы и не зависит от пути, каким система пришла в это состояние. Таким образом: (3)
(3) была введена Клаузиусом и названа им энтропией, в системе СИ измеряется в Дж/К. Наряду с энергией энтропия является важной характеристикой состояния системы. Каждому состоянию системы соответствует одно определенное значение энтропии. Поэтому энтропия является однозначной функцией состояния. Если посредством обратимого процесса система переходит из состояния 1 в состояние 2, то происходящее при этом изменение энтропии системы определяется путем интегрирования равенства (3)
была введена Клаузиусом и названа им энтропией, в системе СИ измеряется в Дж/К. Наряду с энергией энтропия является важной характеристикой состояния системы. Каждому состоянию системы соответствует одно определенное значение энтропии. Поэтому энтропия является однозначной функцией состояния. Если посредством обратимого процесса система переходит из состояния 1 в состояние 2, то происходящее при этом изменение энтропии системы определяется путем интегрирования равенства (3) (4)
(4) (5)
(5) (6)
(6) (7)
(7)


