
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
За допомогою формули (21) обчислити відносну похибку вимірювань коефіцієнта тертя кочення.Содержание книги
Поиск на нашем сайте
8. Обчислити довірчу похибку Δ fk коефіцієнта тертя кочення за формулою:
9. Записати кінцевий результат експериментального вимірювання коефіцієнта тертя кочення у формі:
10. Порівняти одержане експериментальне значення коефіцієнта тертя кочення з табличними даними, які наведено у таблиці 3. Таблиця 3 Коефіцієнти тертя кочення
Лабораторна робота № 4 ВИЗНАЧЕННЯ ВІДНОШЕННЯ ПИТОМИХ ТЕПЛОЄМНОСТЕЙ ГАЗІВ МЕТОДОМ АДІАБАТИЧНОГО РОЗШИРЕННЯ Мета роботи: вивчити метод визначення відношення питомих теплоємностей повітря, визначити експериментально та теоретично числове значення відношення cp/cv, обчислити похибки вимірювання. Прилади та обладнання: балон місткістю 20 л, водяний диференційний манометр зі шкалою, насос.
Теоретичні відомості Питомою теплоємністю речовини називають величину, яка дорівнює кількості теплоти, що необхідно надати одиниці маси речовини для підвищення її температури на 1 K. Для газів ця величина залежить від умов, при яких проходить нагрівання – при сталому об’ємі чи при сталому тиску, і тому виражається відповідно питомою теплоємністю при сталому об’ємі cv та питомою теплоємністю при сталому тиску cp. cv і cp мають різні значення для одного й того ж газу, оскільки кількість теплоти, надана газу при різних умовах, розподіляється по-різному. Згідно з І-м принципом термодинаміки під час нагрівання при сталому об’ємі вся теплота витрачається тільки на збільшення внутрішньої енергії речовини, а під час нагрівання при сталому тиску підведена теплота витрачається на збільшення внутрішньої енергії газу та на виконання роботи проти зовнішніх сил. Безпосередньо виміряти cp і особливо cv важко, бо теплоємність газу становить мізерну долю теплоємності посудини, в якій міститься газ, тому вимірювання виконується неточно. Простіше виміряти відношення cp/cv, яке дасть величину показника адіабати - g. Величина cp/cv = g входить до рівняння Пуассона, яке описує адіабатичний процес зміни стану ідеального газу:
pVg = const. (1)
Співвідношення cp/cv = g залежить тільки від числа ступенів вільності молекул, що входять до складу газу:
де i – число ступенів вільності. Для одноатомного газу i = 3, двоатомного i = 5, триатомного та багатоатомного i = 6. Завдання даної роботи: знайти значення відношення питомих теплоємностей для повітря, яке вважати двоатомним газом.
Опис методу
Метод, який використовується в цій роботі був запропонований Клеманом і Дезормом. В основі його – використання адіабатичного розширення газу. Адіабатичним називається процес, який проходить без теплообміну з навколишнім середовищем. І-й принцип термодинаміки для адіабатичного процесу записується так:
A + DU = 0, або A = – DU,
де DU – зміна внутрішньої енергії газу; A – робота, виконана газом. З цієї формули видно, що робота розширення виконуватиметься за рахунок зміни внутрішньої енергії газу; температура газу при цьому знизиться. Під час же адіабатичного стискання газу його температура підвищиться. Якщо об’єм газу змінюється досить швидко, то внаслідок того, що теплопровідність газу невелика, процес можна розглядати як дуже близький до адіабатичного. Прослідкуємо за послідовністю процесів, що відбуваються у даному лабораторному експерименті та виведемо формулу для обчислення g.
У скляний балон (рис. 1) за допомогою насосу нагнітають повітря, створюючи всередині балону тиск, вищий за атмосферний. Цей стан відповідатиме початку експерименту (рис. 2, точка 1) і описується параметрами p1, V1, T1. Швидке розширення газу можна вважати з достатнім наближенням адіабатичним Тому, відкриваючи кран на короткий час, протягом якого тиск всередині балону досягне атмосферного, можна вважати, що газ перейшов до нового стану, який характеризується параметрами p2, V2, T2<T1 (рис. 2, точка 2). При цьому температура T2 газу після адіабатичного розширення буде меншою від T1. Параметри станів 1 та 2 зв’язані рівнянням адіабатичного процесу. Через 2-3 хвилини після перекривання крану газ нагріється до температури навколишнього повітря T1. Але оскільки під час цього нагрівання V2 залишиться незмінним, то тиск у балоні підвищиться до p3. Новий стан газу характеризується параметрами p3, V2, T1 (рис. 2, точка 3). Порівнявши кінцевий стан газу (точка 3) з початковим (точка 1), бачимо, що вони знаходяться при однаковій температурі. Отже, за законом Бойля - Маріотта
p3V2 = p1V1. (2)
Виконаємо деякі перетворення в цьому рівнянні. Піднесемо його до степеня g і поділимо почленно на рівняння (1):
Прологарифмуємо рівняння (3):
Умови експерименту дають змогу спростити розрахункову формулу. А саме, якщо позначити початковий тиск у балоні p1, початкову різницю рівнів рідини в манометрі H, то
p1 = p2 + bH (5)
де p2 – атмосферний тиск; b – коефіцієнт переходу від різниці рівнів рідини до тиску. Для тиску p3 різницю рівнів позначимо h, тоді
p3 = p2 + bh. (6)
Визначивши
p3 = p1 – b(H–h). (7)
Підставивши p2 і p3 у рівняння (4), знайдемо
Величини Формула (8) буде розрахунковою для визначення g. Порядок виконання роботи
1. Закрити трубку Б (див. рис. 1) і повільно нагнітати повітря в балон, доки різниця рівнів рідини в манометрі не стане рівною 20-30 см. 2. Виміряти значення різниці рівнів рідини H в манометрі. 3. Відкрити трубку Б, випустити з балона надлишок повітря і знов закрити. Проміжок часу з моменту відкриття до моменту закриття дорівнює 1-2 с. 4. При закритій трубці Б чекати 2-3 хв. і виміряти нове значення різниці рівнів рідини h у манометрі. Якщо різниця рівнів рідини в манометрі при вимірах постійно зменшується, то потрібно вжити заходи для забезпечення герметичності системи. Простіше – закрити (перетиснути) трубку А, щоб запобігти натіканню повітря через клапан насосу. 5. Експеримент повторити не менш як 5 разів, зберігаючи одне й те саме значення H та вимірюючи кожен раз значення h. Результати вимірів записати в таблицю 1. Таблиця 1 Результати вимірів та вихідні дані для розрахунку похибок вимірювання H =....., прийнята довірча імовірність a =....., коефіцієнт Стьюдента ta,¥ =....., коефіцієнт Стьюдента ta,5 =.....
dH =....., uH =....., dh =....., uh =.....
Обчислення середніх значень 1. Обчислити середнє значення <h>, результат внести в табл.1. 2. За результатами вимірювання H та середнім значенням <h> визначити експериментальне значення величини <g>. 3. Вважаючи повітря "в середньому" двоатомним газом, прийняти i = 5. Обчислити теоретичне значення величини g.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 79; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.168.176 (0.01 с.) |

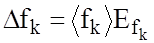 (22)
(22) для α = 0,95 та
для α = 0,95 та  (23)
(23)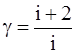 ,
, Рис. 1
Рис. 1
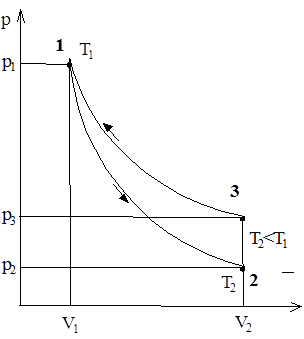 Рис. 2
Рис. 2
 ®
® 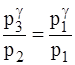 ®
® 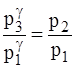 ®
®  (3)
(3)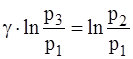
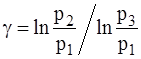 . (4)
. (4) із рівняння (5) і підставивши його в (6), отримаємо
із рівняння (5) і підставивши його в (6), отримаємо
 та
та  набагато менші за одиницю, тому, використавши наближену формулу ln (1-x)» – x, справедливу для малих x, отримаємо
набагато менші за одиницю, тому, використавши наближену формулу ln (1-x)» – x, справедливу для малих x, отримаємо 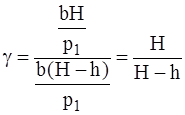 . (8)
. (8) ....
....
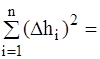 .....
.....



