
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аминотрансферазы. Строение, катализируемые реакции.Содержание книги
Поиск на нашем сайте
Аминотрансферазы – ферменты, принимающие участие в переносе –NH2 гркппс аминокислоты на кетокислоту. Играют важную роль в процессах переаминирования или трансаминирования. Аминотрансфераза состоит из апофермента и кофермента. Кофермент представлен фосфопиридоксалем (B6 + H3PO4)
Имеются многочисленные представители аминотрансфераз. В частности, АЛТ (АЛаТ) – это аланинтрансаминаза (аланинаминотрансфераза) – фермент, который катализирует реакцию переаминирования между аланином и альфа-кетоглутаратом, в результате образуется глутаминовая кислота и пируват. Фермент, катализирующий реакцию между аспарагиновой кислотой и альфа- кетоглутаратом, называется АСТ- аспартаттрансаминаза
28. Значение определения в крови аминотрансфераз (на примере АЛТи АСТ)
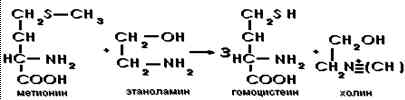
Аминотрансферазы обладают органотропностью и потому определение их активности в сыворотке крови имеет диагностическое значение. Например, АЛТ – фермент, наиболее встречающийся в печени, а АСТ – в миокарде, повышение активности того или иного фермента в сыворотке крови рассматривается как диагностический признак при определенной патологии. 29) Метилтрансферазы. Строение и роль витаминов Вс и В12. Метилтрансферазы-ферменты,переносящие одноуглеродные остатки-метильные, метиленовые,метиновые,оксиметильные,формильные и др., играющие важную роль в процессах метилирования.
Метилтрансферазы-двухкомплектные ферменты. Коферментом является ТГФК-тетрагидрофолиевая кислота-это гидрированное производное фолиевой кислоты(вит Вс)
Все такие производные вместе с фолиевой кислотой объединяются под названием фолацин. Недостаток фолиевой кислоты может вызвать мегалобластную анемию у взрослых. Фолиевая кислота необходима для создания и поддержания в здоровом состоянии новых клеток. В первую очередь от нехватки фолиевой кислоты страдает костный мозг, в котором происходит активное деление клеток. Клетки-предшественники эритроцитов, образующиеся в костном мозге, при дефиците фолиевой кислоты увеличиваются в размере, образуя мегалобласты и приводят к мегалобластной анемии. Необходим беременным женщинам, особенно на ранних сроках беременности. Необходим мужчинам для нормальной выработки сперматозоидов Основная функция фолиевой кислоты и её производных — перенос одноуглеродных групп, например, метильных и формильных, от одних органических соединений к другим. 30) Ацилтрансферазы. Вит В3, строение, роль.
Этот кофермент имеет сложное строение. В состав входят аденозин-3-монофосфат,две молекулы фосф.к-ты,пантотеновая к-та и тиоэтиламин. Функциональной группой НSКоА является SH-группа, поэтому кофермент обозначают НSKoA, а активную форму жирной кислоты 31) Фосфотрансферазы. Фосфотрансферазы, или киназы это ферменты, которые переносят остатки Н3РО4 с одного вещества на другое, ускоряя реакции фосфорилирования. По химической природе большинство фосфотрансфераз однокомпонентные ферменты, но молекулы многих из них состоят из нескольких субъединиц, поэтому они обладают четвертичной структурой и имеют аллостерические центры. Для проявления действия фосфотрансферазам требуются ионы магния. Когда фосфорная кислота присоединяется к веществу, оно становится более реакционно-способным, поэтому фосфотрансферазы называют киназами. Киназы различаются в зависимости от вещества являющегося акцептором фосфорных кислот: I. Источником фосфорных кислот является АТФ: НЕОБРАТИМЫЕ: 1. Гексокиназы. Участвуют в фосфорилировании гексоз. Гексогиназы встречаются во многих клетках. В печени имеется глюкокиназа которая фосфорилирует необратимо только глюкозу: 2.
3. Аденилаткиназы катализируют реакцию: АТФ+АМФ=2АДФ
II. Источник фосфорной кислоты-субстрат. Возможен перенос фосфорной кислоты от других фосфосодержащих веществ на АДФ с образованием АТФ. Такие реакции наз-ся СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ. I реакция:
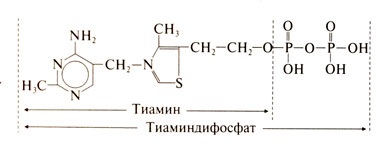
32) Лиазы, общая характеристика, основные группы, каталитическое действие. Этот класс включает ферменты, при действии которых определенные группы (например, аминогруппы, альдегидные группы, но чаще СО2) удаляются из субстратов путем простого отщепления без участия воды. Соответственно удаляемой группе эти ферменты можно назвать дезаминазы, декарбоксилазы, дегидратазы и т.п. лиазы ускоряют и реакции присоединения некоторых групп атомов по месту разрыва двойной связи. В зависимости от того, какие группы они отщепляют различаются: 1) карбокси-лиазы – разрушают связь между двумя углеводами, т.е. способствуют отщеплению со2(декарбоксилазы) или альдегида(альдегид-лиазы) 2) гидро-лиазы способствует отщеплению воды из молекулы(дегидратазы) или способствует гидратации (гидратазы) 3) аммиак-лиазы осуществляют дезаминирование аминокислот с образованием ненасыщенной кислоты Подкласс декарбоксилазы включает два подподкласса – декарбоксилазы кетокислот и декарбоксилазы аминокислот. Декарбоксилазы кетокислот – двухкомпонентные ферменты. Коферментом является тиаминдифосфат — витамин В1 с двумя остатками фосф.кислот)
Связь между апоферментом и коферментом осуществляется за счет ионов магния.
а-кетоглутароватдекарбоксилаза-фермент, декарбоксилирующий и окисляющий а-кетоглутаровую кислоту,способствуя образованию активной янтарной кислоты из а-кетоглутарата
Декарбоксилазы аминокислот По химической природе декарбоксилазы аминокислот – это сложные ферменты, коферментами которых могут являться фосфопиридоксаль(вит В6 связанный с фосф.к-той)
Подкласс-гидролиазы Представитель-карбангидраза- двухкомпонентный фермент, кофермент окончательно не изучен, но известно, что в его состав входит цинк. Фермент ускоряет обратимую реакцию синтеза и распада угольной кислоты Н2О + CO2 = H2CO3 Направление реакции зависит от концентрации СО2, поэтому фермент вызывает удаление избытка угольной кислоты и играет роль в регуляции дыхательного центра.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 2314; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.174.120 (0.008 с.) |




 Витамин Вс(фолиевая кислота)- водорастворимый витамин, необходимый для роста и развития кровеносной и иммунной систем. Наряду с фолиевой кислотой к витаминам относятся и её производные, в том числе ди-, три-, полиглутаматы и другие.
Витамин Вс(фолиевая кислота)- водорастворимый витамин, необходимый для роста и развития кровеносной и иммунной систем. Наряду с фолиевой кислотой к витаминам относятся и её производные, в том числе ди-, три-, полиглутаматы и другие. Ацилтрансферазы-ферменты,которые переносят остатки карбоновых кислот,особенно участки уксусной кислоты(ацетилтрансфераза). Они участвуют в активировании жирных кислот,образуя транспортную и реакционноспособную форму жирной кислоты. Онис состоят из апофермента и кофермента, называемого кофермент ацилирования(КоА).
Ацилтрансферазы-ферменты,которые переносят остатки карбоновых кислот,особенно участки уксусной кислоты(ацетилтрансфераза). Они участвуют в активировании жирных кислот,образуя транспортную и реакционноспособную форму жирной кислоты. Онис состоят из апофермента и кофермента, называемого кофермент ацилирования(КоА). . Биологическая роль НSКоА состоит в том, что только через его посредство осуществляется соединение небольших органических молекул при помощи углеродных связей в сложные высокомолекулярные вещества, т.е. происходит синтез углеродного скелета цитоплазматических компонентов. Поэтому HSКоА находится у всех организмов. Ацилтрансферазы переносят остатки карбоновых кислот, чаще остатки уксусной кислоты и их название формируется по названию переносимой кислоты, например, ацетилтрансфераза.
. Биологическая роль НSКоА состоит в том, что только через его посредство осуществляется соединение небольших органических молекул при помощи углеродных связей в сложные высокомолекулярные вещества, т.е. происходит синтез углеродного скелета цитоплазматических компонентов. Поэтому HSКоА находится у всех организмов. Ацилтрансферазы переносят остатки карбоновых кислот, чаще остатки уксусной кислоты и их название формируется по названию переносимой кислоты, например, ацетилтрансфераза.




 и пирролохинолинохинон (PQQ). ДК аминокислот являются ферментами бактерий, например, в толстом отделе кишечника у животных и человека. Эти ферменты в толстом кишечнике вызывают гниение белков, декарбоксилируя аминокислоты. В клетках человека и животных ДК аминокислот мало. Декарбоксилирование аминокислот также происходит при разложении трупа, когда под действием катепсинов белки тканей распадаются до аминокислот, а ДК аминокислот проводят дальнейшие изменения их
и пирролохинолинохинон (PQQ). ДК аминокислот являются ферментами бактерий, например, в толстом отделе кишечника у животных и человека. Эти ферменты в толстом кишечнике вызывают гниение белков, декарбоксилируя аминокислоты. В клетках человека и животных ДК аминокислот мало. Декарбоксилирование аминокислот также происходит при разложении трупа, когда под действием катепсинов белки тканей распадаются до аминокислот, а ДК аминокислот проводят дальнейшие изменения их


