
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Описание установки и метода изучения процессаСодержание книги Поиск на нашем сайте
Молекулярную газовую постоянную можно определить из уравнения Менделеева-Клапейрона:
где р − давление; V − объем; т − масса газа; М − молярная масса этого газа; Т − абсолютная температура газа. Все параметры газа, входящие в уравнение (17.4), можно измерить непосредственно, за исключением массы газа, так как взвешивание газа возможно только вместе с сосудом, в который он заключен. Поэтому для определения R из (17.4) необходимо исключить массу сосуда. Это можно сделать рассмотрев уравнение состояния двух масс т 1и т 2одного и того же газа при неизменных температуре Т и объеме V. Рассмотрение уравнения состояния (17.4) для двух значений массы газа дает следующее выражение для молярной газовой постоянной:
Следовательно, если определить давление р 1и температуру Т для некоторой массы т 1, заключенной в сосуде объемом V, а затем изменить эту массу до величины т 2(например, путем откачки) и вновь определить давление р 2при той же температуре Т, то по формуле (17.2) можно рассчитать молярную газовую постоянную.
Рис. 17.3. Установка ФПТ-1-12 представляет собой конструкцию настольного типа (рис. 17.3), состоящую из блока управления 1, лока приборного 2, колбы 3, установленной на весах 4 На лицевой панели блока приборного имеются вакуумметр (5), термометр для измерения температуры окружающей среды (6), внутри блока расположен компрессор. Колба установлена на весах и соединена с вакуумметром вакуумной трубкой. Соединение компрессора со штуцером измерительного блока осуществляется с помощью вакуумной трубки. Порядок выполнения работы 1. Подать напряжение питания на электронные весы и включить установку тумблером «СЕТЬ». При этом загорается сигнальная лампа. 2. С помощью электронных весов определить массу колбы с воздухом (т 0 + т 1) при давлении р 1 = р 0 (вакуумная трубка отсоединена от колбы, кран открыт, давление в колбе равно атмосферному). Результаты измерений занести в таблицу 17.1. 3. Взять колбу в руки и аккуратно подсоединить к ней вакуумную трубку. Включить компрессор кнопкой «ПУСК» и, удерживая кнопку нажатой, откачать воздух из колбы до давления р 2 = р 0 – р '(вакуумметр 5 фиксирует давление откачки р '). Отпустить кнопку «ПУСК», закрыть кран, отсоединить вакуумную трубку. Определить массу колбы с воздухом (т 0 + т 2)при давлении р 2. Давление откачки р ' выбирается произвольно из диапазона (- 0,3) – (- 0,8) бар. 4. Открыть кран колбы. Таблица 17.1
5. Повторить п.п. 3,4 ещё 5 раз для различных значений давления откачки, занося результаты измерений в таблицу 17.1. 6. Измерить температуру воздуха в лаборатории. 7. Выключить установку тумблером «СЕТЬ».
Обработка результатов измерений 1. Для каждого проведенного измерения определить массу откаченного воздуха (т 1 – т 2).Результаты занести в таблицу 17.2.Разность давлений (р 1 – р 2) равна давлению откачки р '. По формуле (17.5) вычислить универсальную газовую постоянную R. Молярную массу воздуха принять равной М = 0,029 кг/моль, объём колбы V = 10-3м3. Результаты расчётов занести в табл. 17.2. Таблица 17.2
2. Рассчитать среднее значение Контрольные вопросы 1. Каков физический смысл универсальной газовой постоянной? 2. В чем заключается закон Авогадро? 3. Сделать вывод основного уравнения молекулярно − кинетической теории идеального газа и уравнения Менделеева-Клапейрона. 4. Сформулировать газовые законы для идеальных газов.
Литература: [ 1, § 78, 79, 80, 92]; [ 3, § 86, 89];[ 4, § 10.6-10.8 ]; [ 5 ].
ПРИЛОЖЕНИЕ Таблица П.1 Значение коэффициентов t(n) для случайной величины, имеющей распределение Стьюдента
Таблица П.2 Значение U при разном количестве измерений n для различных доверительных вероятностей.
ЛИТЕРАТУРА 1. И.В. Савельев «Курс общей физики», т. 1, Лань, СПб, М., 2007. 2. Д.В. Сивухин «Общий курс физики», т. 1, Физматлит, М., 2002. 3. Д.В. Сивухин «Общий курс физики», т. 2, Физматлит, М., 2002. 4. А.А. Детлаф,Б.М. Яворский «Курс физики», Академия, М., 2003, 5. В.В. Лентовский «Оценка ошибок результатов измерений», БГТУ, 2005,
Содержание
Введение................................................................................................3 Методические указания к обработке результатов измерений…...... 7 Лабораторная работа № 1. Исследование центрального удара шаров................................................................................................................18 Лабораторная работа № 2. Определение коэффициента трения качения……………………………………………………………………….27 Лабораторная работа № 3. Изучение равноускоренного движения на машине Атвуда……………………………………………….32 Лабораторная работа № 4. Исследование законов динамики вращательного движения твёрдого тела …………………………………..39 Лабораторная работа № 5. Определение скорости монтажного патрона с помощью баллистического крутильного маятника……………46 Лабораторная работа № 6. Определение ускорения свободного падения при помощи математического и оборотного маятников………..52 Лабораторная работа №7. Определение момента инерции маятника Максвелла…………………………………………………………………….61 Лабораторная работа № 8. Определение момента инерции твёрдых тел с помощью крутильных колебаний…………………………………….69 Лабораторная работа № 9. Определение модуля кручения нити и момента инерции системы, совершающей крутильные колебания………78 Лабораторная работа № 10. Определение показателя адиабаты воздуха методом звуковых стоячих волн…………………………………..85 Лабораторная работа № 11. Определение отношения теплоёмкости газа при постоянном давлении к его теплоёмкости при постоянном объёме по адиабатическому расширению газа………………………….....91 Лабораторная работа № 12. Определение отношения молярных теплоёмкостей газа γ = C p/ C V методом адиабатического расширения….104 Лабораторная работа №13. Определение коэффициента вязкости жидкости……………………………………………………………………..109 Лабораторная работа № 14. Определение теплопроводности воздуха……………………………………………………………………….116 Лабораторная работа № 15. Определение коэффициента взаимной диффузии воздуха и водяного пара………………………………………..122 Лабораторная работа №16. Определение коэффициента вязкости воздуха капиллярным методом…………………………………………….130 Лабораторная работа № 17. Определение молекулярной газовой постоянной методом откачки………………………………………………138 Приложение..........................................................................................146 Литература...........................................................................................147
Составители: Васильева Людмила Ивановна, Иванова Наталья Александровна, Иванова Тайми Валентиновна, Ляхович Дмитрий Николаевич, Алексеева Ольга Сергеевна, Лазарева Юлия Николаевна, Князева Татьяна Николаевна.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 336; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.106.66 (0.006 с.) |

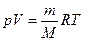 , (17.4)
, (17.4)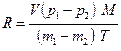 . (17.5)
. (17.5)
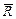 и сравнить его с табличным значением. Оценить погрешность определения R, применяя погрешность прямых измерений.
и сравнить его с табличным значением. Оценить погрешность определения R, применяя погрешность прямых измерений.


