
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методичні вказівки та інструкціяСодержание книги
Поиск на нашем сайте
до лабораторної роботи з курсу „Загальна та неорганічна хімія” для студентів базових напрямків 6.051301 „Хімічна технологія”, 6.051701 „Харчова технологія та інженерія”
Затверджено на засіданні кафедри хімії і технології неорганічних речовин. Протокол №17 від 24.05.2007 р.
Львів – 2007
р – Елементи V групи періодичної системи елементів. Частина 1. Нітроген: Методичні вказівки та інструкція до лабораторної роботи з курсу „Загальна та неорганічна хімія” для студентів базових напрямків 6.051301 „Хімічна технологія”, 6.051701 „Харчова технологія та інженерія” / Укл.: В.Т.Яворський, Р.Р.Оленич, Г.І.Зозуля, Р.Л.Буклів. – Львів: Видавництво Національного університету “Львівська політехніка”, 2007.– 20 с.
Укладачі Яворський В.Т., д-р техн. наук, проф., Оленич Р.Р., канд. хім. наук, доц., Зозуля Г.І., канд. техн. наук, доц. Буклів Р.Л., канд. техн. наук, доц.
Відповідальний за випуск Яворський В.Т., д-р техн. наук, проф.
Рецензент Калимон Я.А., д-р техн. наук, проф.
Мета роботи - ознайомлення студентів з властивостями p-елементів Y групи та найважливіших сполук Нітрогену. Під час виконання лабораторного практикуму студенти вивчають основні способи одержання азоту та сполук Нітрогену, а також їх фізичні та хімічні властивості.
ТЕОРЕТИЧНИЙ ВСТУП 1.1. Загальна характеристика р-елементів Y групи
До р-елементів Y групи належать: N (Нітроген), Р (Фосфор), As (Арсен), Sb (Стибій) і Bi (Бісмут). Атоми цих елементів на зовнішньому енергетичному рівні мають по 5 електронів (електронна конфігурація зовнішніх енергетичних рівнів атомів - ns2nр3), які в нормальному стані розміщені на енергетичних підрівнях так:
N P,As,Sb,Bi В нормальному стані р-елементи Y групи мають валентність 3. У атома елемента другого періоду (Нітрогену) відсутній d-підрівень, тому, на відміну від інших р-елементів Y групи, Нітроген не може мати валентність 5. Для Фосфору, Арсену, Стибію і Бісмуту, завдяки наявності зовнішніх d-орбіталей, можливе розпарування s-електронів, тому число неспарених електронів може збільшуватися до п’яти. Можливі ступені окиснення р-елементів Y групи наведені в табл.1. Таблиця 1
* Характерні ступені окиснення елементів підкреслено, нехарактерні взято в дужки Здатність до утворення сполук зі ступенем окиснення +5 від Нітрогену до Бісмуту послаблюється, стабілізується нижчий позитивний ступінь окиснення +3. Для Бісмуту ступінь окиснення +5 є нехарактерним внаслідок підвищеної стійкості 6s2-електронної конфігурації за рахунок збільшення енергетичної різниці s- і p-підрівнів. Стійкість сполук з мінімальним ступенем окиснення -3 також зменшується від Нітрогену до Бісмуту. Для Бісмуту мінімальний ступінь окиснення – 0, оскільки бісмут – метал. В табл.2 наведено деякі властивості р-елементів Y групи та простих речовин. Таблиця 2
Зі збільшенням протонного числа від Нітрогену до Бісмуту значно та закономірно зростають радіуси атомів, зменшуються значення енергії іонізації та електронегативності, тому неметалічні властивості послаблюються від азоту до стибію. Азот і фосфор – типові неметали. Металічні властивості починають виявлятися в арсену, стибій приблизно однаковою мірою виявляє як металічні, так і неметалічні властивості. Бісмут виявляє металічні властивості. Властивості азоту та сполук Нітрогену виявляють ряд індивідуальних особливостей, тому надалі розглядатимуться окремо.
1.2. Поширення Нітрогену у природі, одержання та властивості азоту Природних сполук Нітрогену у земній корі практично немає (масова частка Нітрогену у земній корі становить лише 0,04%). Але Нітроген входить до складу білків та амінокислот, тому є необхідним для формування рослин, розвитку тваринних та людського організмів. Основна маса Нітрогену знаходиться у вільному стані в атмосфері у вигляді простої речовини – азоту (об’ємна частка азоту у повітрі становить 78,03%). Над 1 м2 поверхні Землі знаходиться близько 5 т N2, але цей азот є практично непридатним для споживання тому, що у рослини і тварини він надходить тільки у хімічно зв’язаному стані. Винятком є рослини родини бобових, на коренях яких поселяються бактерії, що переробляють азот на нітрогенвмісні сполуки. В природних процесах Нітроген зі зв’язаного стану здебільшого перетворюється в молекулярний азот. Лише два природних процеси зумовлюють поповнення зв’язаного Нітрогену – утворення NO в плазмі грозових розрядів та діяльність деяких видів мікроорганізмів, що населяють грунти і здатні зв’язувати атмосферний азот. Тому в умовах інтенсивного розвитку сільського господарства існує проблема зв’язаного азоту. Її вирішують шляхом виробництва синтетичного аміаку, з якого добувають інші сполуки Нітрогену. Зокрема у грунт вносять азотні добрива для поповнення запасу Нітрогену, оскільки щороку з полів із урожаєм виноситься величезна його кількість. У промисловості азот добувають ректифікацією зрідженого повітря. У лабораторних умовах використовують азот промислового виробництва (транспортують у стальних балонах, а рідкий азот - у посудинах Дьюара). Невеликі кількості азоту в лабораторних умовах добувають термічним розкладанням деяких сполук Нітрогену, наприклад:
Азот високого ступеня чистоти добувають термічним розкладом натрію азиду:
За звичайних умов азот – безбарвний газ без кольору і запаху з температурою топлення -210 оС і температурою кипіння - 196 оС. Він погано розчиняється у воді, не підтримує дихання живих організмів, але є неотруйним. Азот є хімічно інертною речовиною. Це пояснюється тим, що у молекулі N2 атоми сполучені потрійним зв’язком (один з них є s-звязком, а два інші - p-зв’язками). Тому молекула N2 є дуже міцною, енергія дисоціації молекули азоту дорівнює 945,3 кДж/моль. Навіть за температури 3000оС ступінь дисоціації молекулярного азоту становить лише 0,1%. В окисно-відновних реакціях азот виявляє відновні властивості лише у разі взаємодії з киснем і фтором, елементи яких мають вищу електронегативність, ніж Нітроген. При цьому реакція з киснем відбувається за температури вище 3000оС (температура електричної дуги): N2 + O2 D 2 NO. У реакціях з іншими речовинами азот виступає як окисник. За кімнатної температури він реагує тільки з літієм з одержанням нітриду Li3N. Під час нагрівання азот реагує з металами і неметалами з утворенням нітридів: 3 Ca + N2 t ® Ca3N2; 2 B + N2 t ® 2 BN.
1.3. Сполуки Нітрогену з від’ємними ступенями окиснення
Найважливішими сполуками Нітрогену з від’ємними ступенями окиснення є сполуки з Гідрогеном і металами: аміак NH3, гідразин N2H4, гідроксиламін NH2OH, азидна кислота HN3 і нітриди ExNy.
У промисловості аміак виробляють каталітичним синтезом із азоту і водню за реакцією: N2 + 3 H2 p,T D 2 NH3 + Q. Ця реакція є оборотною, екзотермічною та відбувається зі зменшенням об’єму. Отже, сприятливими умовами для зміщення рівноваги праворуч є підвищений тиск та низька температура (принцип Ле-Шательє). Оскільки рівновага сильно зміщена ліворуч, добитись повного переведення вихідних газів в аміак неможливо навіть за високих тисків (100 МПа). Тому синтез аміаку здійснюють у циркуляційному режимі (одержаний аміак конденсують, а непрореаговані азот і водень повертають у процес). Без каталізатора синтез аміаку практично не відбувається. Каталізатором слугує пористе залізо активоване Al2O3, K2O. Оптимальна температура залізного каталізатора – 400-600оС. У лабораторних умовах аміак можна одержати з солей амонію під дією на них лугів: 2 NH4Cl + Ca(OH)2 ® CaCl2 + 2 NH3 + 2 H2O. За звичайних умов аміак – безбарвний газ з різким специфічним запахом. Молекула NH3 має форму тригональної піраміди, у вершині якої розміщений атом Нітрогену: ..
H H H
Аміак є донором електронів відносно іона Гідрогену (Н+), який має вільну s-орбіталь і приймає неподілену пару електронів атома Нітрогену з утворенням іона амонію NH4+. Наявністю неподіленої пари електронів і полярністю зв’язку N – H пояснюється також виникнення між молекулами аміаку водневого зв’язку. Тому аміак легко зріджується і має велике значення теплоти пароутворення, на чому ґрунтується його застосування в холодильних машинах. Під час взаємодії аміаку з водою утворюються водневі зв’язки між атомами Нітрогену і атомами Гідрогену води. Цей зв’язок наближається до донорно-акцепторного, а дисоціація на іони відбувається лише частково: NH3 + H2O D NH3 . H2O D NH4+ + OH-. Умовно водний розчин аміаку зображають формулою NH4OH і називають амонію гідроксидом, а лужну реакцію розчину аміаку розглядають як наслідок дисоціації умовних молекул NH4OH. Аміак добре розчиняється у воді (за температури 20оС в одному об’ємі води розчиняється 700 об’ємів аміаку). Водний розчин аміаку – слабка основа, константа дисоціації якої за температури 18оС дорівнює 1,8.10-5. Для аміаку характерні три типи реакцій: 1) комплексоутворення; 2) окисно-відновні; 3) заміщення. Як донор аміак добре взаємодіє з розчинами кислот та іонами d-елементів з утворенням солей амонію і аміакатів відповідно: 2 NH3 + H2SO4 ® [NH4]2SO4; 4 NH3 + CuSO4 ® [Cu(NH3)4]SO4. Оскільки атом Нітрогену в молекулі аміаку має найнижчий ступінь окиснення (-3), то у окисно-відновних реакціях він виявляє лише відновні властивості. Без каталізатора аміак горить зеленкуватим полум’ям:
У промисловості основна маса аміаку витрачається на виготовлення нітратної кислоти і азотних добрив. При цьому під час пропускання аміаку і повітря над платиново-родієвим каталізатором за температури 750оС аміак окиснюється до нітрогену(II) оксиду:
З активними металами аміак утворює аміди, іміди і нітриди цих металів відповідно: 2 Na + 2 NH3 ® 2 NaNH2 + H2; 2 Na + NH3 ® Na2NH + H2; 6 Na + 2 NH3 ® 2 Na3N + 3 H2 . Аміди, іміди і нітриди активних металів легко розкладаються водою і кислотами, наприклад: Na2NH + 2 H2O ® 2 NaOH + NH3; NaNH2 + 2 HCl ® NaCl + NH4Cl. Більшість солей амонію добре розчиняються у воді. Оскільки іон NH4+ є катіоном слабкого гідроксиду, то солі амонію гідролізують. Зокрема, розчини солей амонію, утворених сильними кислотами, мають слабкокислу реакцію: NH4+ + HOH D NH4OH + H+. Солі амонію можуть розкладатися оборотно і необоротно. Оборотно розкладаються солі амонію, аніони яких не є окисниками, наприклад: NH4Cl D NH3 + HCl. Солі амонію, аніони яких є окисниками, розкладаються необоротно, тобто відбувається окисно-відновна реакція:
Амонійна і калійна селітри (NH4NO3, KNO3) – цінні мінеральні добрива з високим відсотковим вмістом Нітрогену, що засвоюється рослинами.
Нітриди. Властивості нітридів закономірно змінюються за періодами і групами періодичної системи. В малих періодах спостерігається перехід від основних нітридів до кислотних (Na3N – основний, AlN – амфотерний, P3N5 – кислотний). Нітриди s-елементів та інших активних металів – кристалічні сполуки з іонно-ковалентним зв’язком, які розкладаються водою і кислотами: Ca3N2 + 6 H2O ® 3 Ca(OH)2 + 2 NH3; AlN + 4 HCl ® AlCl3 + NH4Cl. Нітриди d-елементів – металічні сполуки змінного складу. Вони характеризуються високою твердістю, металічним блиском і електропровідністю, є хімічно стійкими, не розкладаються водою і розчинами кислот. Завдяки цим властивостям металічні нітриди використовують для виготовлення спеціальних керамічних матеріалів.
У молекулі гідразину H2N-NH2 два атоми Нітрогену мають неподілені пари електронів, тому він здатний до реакцій приєднання. Гідразин, як і аміак, має підвищену електронно-донорну здатність. Основні властивості гідразину виражені сильніше, ніж в аміаку. Гідразин – безбарвна рідина. З водою змішується в будь-яких співвідношеннях. Водні розчини гідразину мають лужну реакцію: N2H4 + 2 H2O D [N2H6](OH)2 D [N2H6]2+ + 2 OH-. [N2H6](OH)2 – слабка двохкислотна основа. Гідразин утворює з кислотами два ряди солей гідразонію - [N2H6]Cl2 і [N2H5]Cl. Гідразин є значно менш стійким, ніж аміак і солі амонію. Ступінь окиснення атома Нітрогену в його молекулі дорівнює -2, тому він може виявляти як відновні, так і окисні властивості. Гідразин – сильний відновник:
У суміші з киснем гідразин згоряє з виділенням величезної кількості теплоти, тому його використовують як компонент ракетного палива:
Гідразин та всі його похідні сполуки дуже отруйні. Добувають гідразин окисненням аміаку, наприклад, натрію гіпохлоритом:
Гідроксиламін – біла кристалічна речовина, яку можна добути електрохімічним відновленням нітратної кислоти атомарним воднем: HNO3 + 6 H ® NH2OH + 2 H2O. Гідроксиламін розкладається з вибухом під час нагрівання, з водою змішується у будь-яких співвідношеннях. Подібно до аміаку і гідразину, водні розчини гідроксиламіну виявляють слабкі основні властивості: NH2OH + H2O D [NH3OH]OH D [NH3OH]+ + OH-. З кислотами гідроксиламін утворює солі гідроксиламонію, наприклад [NH3OH]Cl.
Азидну кислоту HN3 можна одержати дією на гідразин нітритною кислотою: N2H4 + HNO2 ® HN3 + 2 H2O. Азидна кислота HN3 – безбарвна рідина з різким запахом. Вона належить до слабких кислот. Водні розчини HN3 дисоціюють: HN3 D H+ + N3-.
Азиди мають низьку стійкість. Азиди малоактивних металів, наприклад плюмбуму, розкладаються з вибухом: Pb(N3)2 удар® Pb + 3 N2. Азидом плюмбуму заповнюють капсулі-детонатори.
1.4. Сполуки Нітрогену з позитивними ступенями окиснення
Нітроген виявляє позитивні ступені окиснення лише у сполуках з елементами, що мають вищі значення електронегативності – Оксигеном і Флюором. Найважливіші сполуки Нітрогену з позитивними ступенями окиснення: оксиди, нітритна і нітратна кислоти та солі цих кислот. Оксиди Нітрогену.
оксиди, за винятком N2O, отруйні. Нітрогену(I) оксид добувають нагріванням амонію нітрату:
Молекула N2O має лінійну будову: N = N = O. N2O – несолетвірний оксид. N2O – безбарвний газ, солодкуватий на смак, має приємний запах. Його називають “веселильним газом”, оскільки вдихання великої кількості N2O викликає стан, подібний до сп’яніння. Суміш N2O з киснем застосовують для наркозу. N2O погано розчиняється у воді та не реагує з нею. Нітрогену(II) оксид добувають у великих кількостях на виробництві нітратної кислоти окисненням аміаку на платиново-родієвому каталізаторі:
У лабораторних умовах NO добувають взаємодією розведеного розчину HNO3 (30-35%) з міддю:
NO – безбарвний газ, отруйний, погано розчиняється у воді (в одному об’ємі води за температури 0оС розчиняється 0,07 об’єму NO). NO – термодинамічно нестійка сполука, належить до несолетвірних оксидів. Атом Нітрогену в молекулі NO містить неспарений електрон, що зумовлює здатність NO до утворення в газовій фазі нестійкого димера N2O2. У твердому стані оксид повністю складається з молекул N2O2. Від молекули NO можна відщепити неспарений електрон, внаслідок чого утворюється нітрозил-іон NO+. Нітрозилгалогеніди утворюються під час взаємодії NO з галогенами:
В окисно-відновних реакціях NO виявляє відновні та окисні властивості, але переважаючою є відновна функція. Так, з киснем NO реагує за звичайних умов:
Нітрогену(III)оксид добувають за реакцією:
Рівновага реакції зсунута ліворуч, тому N2O3 є нестійкою сполукою. За температури 25оС N2O3 – рідина зеленого кольору. N2O3 – солетворний кислотний оксид. Внаслідок розчинення N2O3 у воді утворюється нітритна кислота HNO2. Нітрогену(IY) оксид за звичайних умов – газ бурого кольору, отруйний, має неприємний запах. Під час охолодження рідкого NO2 утворюються безбарвні кристали димеру N2O4 з температурою топлення -11оС.
О 0,5- За температури понад 140оС газоподібний нітрогену(IY ) оксид існує лише у мономерному стані. З точки зору кислотно-основних властивостей NO2 формально поводиться як кислотний оксид, зокрема, на відміну від NO, він добре розчиняється у воді з утворенням нітритної та нітратної кислот:
NO2 також взаємодіє з розчинами лугів з утворенням нітритів і нітратів:
Наведені вище реакції взаємодії NO2 з водою та лугами належать до окисно-відновних реакцій диспропорціонування, що підтверджує здатність NO2 виступати як окисником, так і відновником. Проте, на відміну від NO, для NO2 більш характерні окисні властивості. Він легко окиснює SO2 до SO3:
Нітрогену(Y)оксид можна добути, діючи сильним водовідбирним засобом, наприклад P2O5, на нітратну кислоту: 2 HNO3 + P2O5 ® N2O5 + 2 HPO3. N2O5 – нестійка біла кристалічна речовина, яка навіть за кімнатної температури розкладається на NO2 і O2. Нітрогену(Y) оксид - сильний окисник, в середовищі якого органічні речовини займаються. N2O5 є ангідридом нітратної кислоти.
Нітритна кислота Нітритна кислота HNO2 належить до слабких кислот (Кд= 5.10-4). Це нестійка сполука, існує лише в розчинах, розкладається з виділенням NO і NO2:
Солі цієї кислоти називають нітритами. Нітрити значно стійкіші, ніж нітритна кислота, і є отруйними. Нітритна кислота та її солі завдяки наявності атома Нітрогену з проміжним ступенем окиснення можуть виявляти відновні і окисні властивості:
Нітратна кислота Нітратна кислота HNO3 та її солі мають велике значення в народному господарстві. У промисловості нітратну кислоту добувають каталітичним окисненням NH3 до NO. Потім NO окиснюють киснем повітря до NO2 і суміш NO2 з надлишком повітря поглинають водою або розбавленим розчином нітратної кислоти. Сумарне рівняння останньої реакції можна записати так: 3 NO2 + H2O D 2 HNO3 + NO. Промисловістю випускається розбавлена (45-, 47- і 55%-ві розчини) і концентрована (98%-ий розчин) кислоти. Концентровану нітратну кислоту добувають перегонкою 50%-го розчину HNO3 за наявності H2SO4, що відіграє роль водовідбирного засобу. Концентрована нітратна кислота – безбарвна рідина з температурою кипіння +86оС, температурою замерзання -41оС і густиною 1,51г/см3. На відміну від сульфатної кислоти нітратна характеризується високим парціальним тиском парів NO, HNO3. Тому вона на повітрі “димить” внаслідок утворення її парою з вологою повітря дрібних крапель туману. Концентрована HNO3 має буре забарвлення, оскільки під впливом світла і теплоти розкладається з виділенням бурого NO2 :
HNO3 – дуже сильна кислота. З водою утворює азеотропну суміш, що містить 68,4% HNO3. Валентність Нітрогену у більшості сполук дорівнює 3. Але у деяких випадках вона може змінюватися внаслідок переходу валентних електронів від одного атома. Покажемо це на прикладі нітратної кислоти. Насправді в молекулі HNO3 між атомом Нітрогену і трьома атомами Оксигену утворюється не три, а чотири ковалентні зв'язки і п’ятий іонний. При переході електрона від атома Нітрогену до атома Оксигену валентність Нітрогену зростає до 4, а Оксигену зменшується від 2 до 1. При цьому утворюються два іони. Внаслідок цього в молекулі HNO3 між атомом Нітрогену і одним атомом Оксигену виникає один іонний та один ковалентний звязок, а інші три зв'язки Нітрогену з Оксигеном є ковалентними: -
O Будову молекули HNO3 зображено на рис.1
Рис.1. Будова молекули HNO3
Молекула HNO3 є плоскою. Два атоми Оксигену сполучені з атомом Нітрогену зв'язками однакової довжини (0,121 нм) під кутом 130о, а третій має більшу довжину зв'язку (0,141 нм). Така форма молекули зумовлює її високу полярність і низьку стійкість. Концентрована і розбавлена нітратна кислота є сильним окисником. Вона окиснює майже всі метали і неметали. Деякі метали (Al,Cr) концентрована HNO3 пасивує: 2 Al + 6 HNO3(конц.) ® Al2O3 + 6 NO2 + 3 H2O. Тому концентровану нітратну кислоту перевозять в алюмінієвих цистернах. З більшістю металів (за винятком Au,Pt,Ta,Rh,Ir) нітратна кислота взаємодіє з утворенням нітратів металів. При цьому Нітроген може відновлюватися до різних продуктів: NO2, NO, N2O, N2, NH4NO3. Утворення відповідних продуктів відновлення HNO3 залежить від активності металу і концентрації кислоти. Чим активніший метал і більш розбавлена кислота, тим глибше (до нижчих ступенів окиснення) відбувається відновлення Нітрогену. Зокрема, активні метали (цинк, магній) можуть відновлювати розбавлену HNO3 до N2O і N2, а дуже розбавлену навіть до NH4NO3. Під час взаємодії розбавленої HNO3 з малоактивними металами (міддю) виділяється NO, наприклад: 4 Zn + 10 HNO3(розб.) ® 4 Zn(NO3)2 + N2O + 5 H2O; 5 Mg + 12 HNO3(розб.) ® 5 Mg(NO3)2 + N2 + 6 H2O; 4 Mg + 10 HNO3(дуже розб.) ® 4 Mg(NO3)2 + NH4NO3 + 3 H2O; 3 Cu + 8 HNO3(розб.) ® 3 Cu(NO3)2 + 2 NO + 4 H2O. Концентрована HNO3 може відновлюватися металами різної активності до NO2, наприклад: Cu + 4 HNO3(конц.) ® Cu(NO3)2 + 2 NO2 + 2 H2O. Суміш концентрованих HNO3 і HCl (1: 3), яку називають “царською водою”, розчиняє золото і платинові метали, наприклад: Au + HNO3 + 4 HCl ® H[AuCl4] + NO + 2 H2O. Розчинення золота і платинових металів у “царській воді” термодинамічно можливе завдяки комплексоутворенню, а велика швидкість реакції забезпечується наявністю атомарного хлору і хлориду нітрозилу NOCl, які утворюються під час взаємодії HNO3 і HCl та активно взаємодіють з золотом. Під час взаємодії неметалів з концентрованою нітратною кислотою утворюються відповідні кислоти і нітрогену оксиди (NO2 і NO), наприклад: S + 6 HNO3(конц.) ® H2SO4 + 6 NO2 + 2 H2O; 3 P + 5 HNO3(конц.) ® 3 HPO3 + 5 NO +H2O. Солі HNO3 – нітрати, добре розчинні у воді. На відміну від нітратної кислоти їх розчини майже не виявляють окисних властивостей. Вони є сильними окисниками за високих температур при сплавленні. Під час нагрівання нітрати розкладаються. Нітрати активних металів перетворюються на нітрити: 2 KNO3 t ® 2 KNO2 + O2. Нітрати менш активних металів розкладаються з утворенням оксидів цих металів, кисню і нітрогену(IY) оксиду: 2 Cu(NO3)2 t ® 2 CuO + 4 NO2 + O2. Нітрати металів, оксиди яких є нестійкими, розкладаються з виділенням вільного металу: 2 AgNO3 t ® 2 Ag + 2 NO2 + O2. ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ Під час виконання роботи небезпеку становлять: - концентровані кислоти і луги; - скляний лабораторний посуд. Тому всі роботи потрібно виконувати, суворо дотримуючись правил техніки безпеки в хімічній лабораторії. Насамперед необхідно: - працювати в халатах; - роботи з концентрованими реактивами виконувати лише у витяжній шафі; - обережно поводитись зі скляним посудом.
Лабораторні досліди 1. Одержання азоту. Змішайте в пробірці по 2 мл розчинів калію нітриту і амонію хлориду. Суміш обережно нагрійте на невеликому полум´ї пальника. При інтенсивному виділенні газу припиніть нагрівання. Піднесіть до газу, який виділяється, палаючу скибку. Що при цьому спостерігається? Напишіть рівняння відповідних реакцій. 2. Одержання аміаку. До 2 мл розчину амонію хлориду або сульфату долийте 2 мл розчину натрію гідроксиду і нагрійте до кипіння. Смужку фільтрувального паперу змочіть фенолфталеїном та потримайте в парах біля отвору пробірки. Що при цьому спостерігаєте? Напишіть рівняння реакції одержання аміаку і дисоціації його гідроксиду. 3. Вивчення стійкості аміаку. Нагрійте розчин аміаку. В якому напрямку зміщується рівновага в системі аміак – вода при зміні температури? 4. Взаємодія аміаку з кислотами. В пробірку налийте 2 мл сульфатної або хлоридної кислоти, 1-2 краплі індикатора метилоранжу і поступово доливайте водного розчину аміаку. Спостерігайте зміну кольору індикатора. Напишіть рівняння реакції в молекулярній та іонній формах. 5. Обмінні реакції амонію гідроксиду з солями. У дві пробірки з розчинами феруму (ІІІ) хлориду і плюмбуму (ІІ) нітрату долийте надлишок розчину аміаку до утворення осаду. Напишіть відповідні рівняння реакцій. 6. Окиснення аміаку. До 2 мл бромної води по краплях долийте розчин аміаку. Який газ при цьому виділяється? Напишіть рівняння відповідної реакції. 7. Одержання комплексного аміакату купруму. У дві пробірки налийте по 2 мл розчинів купруму (ІІ) сульфату і кобальту (ІІ) хлориду. В кожну з них додайте по 2 мл розведеного розчину натрію гідроксиду. До одержаних осадів долиите надлишок концентрованого розчину аміаку. Як і чому зміниться колір реакційного середовища в обох пробірках? Напишіть рівняння відповідних реакцій. 8. Виявлення іонів амонію. А) В пробірку з 1-2 мл розчину амонію хлориду додайте 2 мл розчину реактиву Неслера (K2[HgI4]+KOH). При наявності іона NH4+ утворюється червоно-бурий осад, а при малій концентрації цих іонів - темно-жовте забарвлення: NH4Cl+2 K2[HgI4]+4KOH= Це найчутливіша реакція на аміак і солі амонію. Б) У пробірку налийте 2 мл розчину амонію хлориду або іншої солі амонію і 2 мл 2 N розчину натрію гідроксиду. Суміш нагрійте. До отвору пробірки, не доторкуючись її стінок, піднесіть лакмусовий папірець. Посиніння папірця засвідчує наявність у розчині іонів NH4+. 9. Одержання солей амонію. (Дослід проводити у витяжній шафі!). У тигель налийте 2 мл розчину аміаку. Потім змочіть дно і стінки склянки концентрованою хлоридною кислотою, залишок якої злийте. Цією склянкою накрийте тигель з розчином аміаку. Поясніть свої спостереження. Напишіть рівняння відповідних реакцій. 10. Гідроліз солей амонію. Дослідіть характер середовища розчинів амонію хлориду і карбонату. Чому твердий амонію карбонат помітно пахне аміаком? Напишіть рівняння реакцій гідролізу зазначених солей в молекулярній та іонній формах. 11. Термічна дисоціація амонію хлориду. У суху пробірку насипте 1 г амонію хлориду і, закріпивши пробірку в штативі похило отвором угору, спочатку повільно, а потім сильніше нагрівайте над полум'ям пальника доти, доки вся сіль не відкладеться на бічних стінках пробірки у вигляді конденсату. Упродовж нагрівання стежте за зміною забарвлення лакмусового папірця, змоченого водою, тримаючи його в отворі пробірки. Сіль з бічних стінок пробірки змивайте водою (1-2 мл) і розділіть розчин у дві пробірки. В одній виявіть іони NH4+, як описано у п.8, у другій - іони Cl-. Для виявлення іонів Cl- до розчину додайте декілька крапель аргентуму нітрату, розчин аміаку до розчинення осаду, що утворився, а потім розчин нітратної кислоти до кислої реакції. Білий осад аргентуму хлориду, який з'являється знову, підтверджує наявність у розчині іонів Сl-. Напишіть відповідні рівняння реакцій. 12. Відновні властивості аміаку. Налийте у пробірку 2 мл розчину калію перманганату і підкисліть розбавленою сульфатною кислотою. До одержаного розчину долийте 2 мл розчину натрію нітриту. Внаслідок переходу Mn+7 до Mn+2 проходить зміна забарвлення розчину. Напишіть відповідне рівняння реакції та спостереження.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 141; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.242.169 (0.018 с.) |




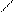 N
N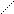
 Довжина зв’язку N-H дорівнює 0,101 нм, HNH = 107,3о. Геометрія молекули NH3 визначається [s2]p3 – гібридизацією атомних орбіталей: об’ємна фігура близька до тетраедра. Молекула NH3 є різко вираженим донором пари електронів і має високу полярність.
Довжина зв’язку N-H дорівнює 0,101 нм, HNH = 107,3о. Геометрія молекули NH3 визначається [s2]p3 – гібридизацією атомних орбіталей: об’ємна фігура близька до тетраедра. Молекула NH3 є різко вираженим донором пари електронів і має високу полярність.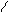
 Молекула NO2 має кутову форму (ONO = 126o). У молекулі NO2 атом Нітрогену перебуває у стані sp2-гібридизації (за рахунок 2s-, 2px- і 2pz-орбіталей). Одну з гібридизованих орбіталей займає неспарений електрон, що зумовлює парамагнітні властивості NO2, а дві інші гібридизовані орбіталі беруть участь в утворенні σ-зв’язків NO. Крім того, 2pz-орбіталі атома Нітрогену і 2px-орбіталі двох атомів Оксигену беруть участь в утворенні делокалізованого зв'язку, що відповідає кратності 1,5:
Молекула NO2 має кутову форму (ONO = 126o). У молекулі NO2 атом Нітрогену перебуває у стані sp2-гібридизації (за рахунок 2s-, 2px- і 2pz-орбіталей). Одну з гібридизованих орбіталей займає неспарений електрон, що зумовлює парамагнітні властивості NO2, а дві інші гібридизовані орбіталі беруть участь в утворенні σ-зв’язків NO. Крім того, 2pz-орбіталі атома Нітрогену і 2px-орбіталі двох атомів Оксигену беруть участь в утворенні делокалізованого зв'язку, що відповідає кратності 1,5:
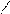 О 0,5-
О 0,5-


 + N
+ N + O
+ O


 H O N
H O N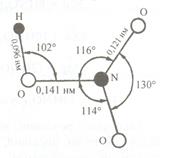
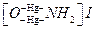 + 7KI + KCl+3H2O
+ 7KI + KCl+3H2O


