
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пересчет мольных долей В массовыеСтр 1 из 2Следующая ⇒
КУРСОВОЙ ПРОЕКТ По теме: Равновесие «Жидкий раствор (расплав) – кристаллы» в двухкомпонентной системе Вариант 4
Выполнил: студент гр. Мт-201301 Бражников Н.А. Преподаватель: Урицкая А.А.
Екатеринбург 2012 СОДЕРЖАНИЕ
1. Задание для курсового проекта 1.1. Условие задачи 1.2. Исходные данные 2. Пересчет мольных долей в массовые для компонента А. Построение изобарной диаграммы в координатах Т-φА 3. Описание диаграммы плавкости по областям 4. Кривые охлаждения 4.1. Правило фаз Гиббса 4.2. Расчет 5. Определение массы кристаллов 5.1. Вывод правила рычага 5.2. Расчет 6. Уравнение Шредера 6.1. Вывод уравнения 6.2. Применение 6.3. Расчеты 6.3.1. Расчет мольных теплот плавления веществ А и В 6.3.2. Расчет температур начала кристаллизации компонентов А и В 6.3.3. Расчет коэффициентов активности компонентов А и В 6.3.4. Расчет криоскопических постоянных веществ А и В 7.Библиографический список 8. Приложение
ЗАДАНИЕ ДЛЯ КУРСОВОГО ПРОЕКТА Условие задачи 1. Данные эксперимента для каждого варианта должны быть взяты из табл. «Зависимость температуры начала кристаллизации расплава от его состава (в мольных долях)». По этим данным построить изобарную диаграмму (T – NA). 2. Выведите уравнение для пересчета мольных долей в массовые для компонента А. Представьте в табличной форме результаты пересчета мольных долей (NА) в массовые доли (φА) и постройте изобарную диаграмму в координатах T - φА. 3. Опишите диаграмму плавкости по областям. 4. Начертите все типы кривых охлаждения (кривые в координатах «температура – время» и опишите их, опираясь на правило фаз Гиббса). 5. Выведите уравнение для расчета масс равновесных фаз (правило рычага) в областях диаграммы (T - φА), где находятся: а) кристаллы компонентов А – расплав; б) кристаллы компонентов В – расплав. 6. Рассчитайте массу выделившихся кристаллов при охлаждении 2кг расплава. Состав расплава задается преподавателем. 7. Выведите уравнение Шредера и рассчитайте мольные теплоты плавления веществ А и В в приближении совершенного раствора (Nk → 1). 8. Рассчитайте, используя уравнение Шредера, температуры начала кристаллизации компонентов А и В из расплавов разного состава. Сравните экспериментальные кривые кристаллизации (диаграмма T – NA) с рассчитанными.
9. Рассчитайте коэффициенты активности компонентов А и В в растворах с NA=70% и NB=67.5%. 10. По понижению температур начала кристаллизации веществ А и В из растворов состава NA=70% и NB=67.5% определите значение криоскопической постоянной веществ А и В по экспериментальным данным. Исходные данные
Для решения задачи были получены следующие данные: двухкомпонентная система представляет собой расплав солей Li2CO3 (вещество А) и K2CO3 (вещество В). Этим веществам соответствуют молярные массы МА=73.89•10-3 кг/моль, МВ=138•10-3 кг/моль. Зависимость температуры начала кристаллизации раствора от состава раствора приведена в табл. 1.1. Таблица 1.1.
По приведенным данным строим изобарную диаграмму зависимости температуры начала кристаллизации системы от состава в координатах Т – NA (рис.1). ПЕРЕСЧЕТ МОЛЬНЫХ ДОЛЕЙ В МАССОВЫЕ Массовая доля вещества в двухкомпонентной системе представляет собой отношение массы этого вещества к общей массе системы.
Разделив это уравнение на массу компонента А, получаем
Представив массу компонента в виде произведения молярной массы компонента на число молей, получаем
Мольная масса компонента в двухкомпонентной системе представляет собой отношение числа молей компонента к общему числу молей системы.
Следовательно, отношение мольных долей компонентов равно отношению числа молей соответствующих компонентов.
Подставив уравнение (2.5) в уравнение (2.3), получаем формулу для пересчета мольной доли компонента в массовую:
Результаты пересчета приведены в табл. 2.1. Таблица 2.1.
По полученным данным строим изобарную диаграмму в координатах Т -
КРИВЫЕ ОХЛАЖДЕНИЯ По диаграмме кристаллизации строим кривые охлаждения (рис.3) Вариантности системы в точках, принадлежащих данным кривым, описываем по правилу фаз Гиббса. Правило фаз Гиббса. Если в гетерогенной системе давление и температура во всех фазах одинаковы, а число молей всех компонентов в каждой фазе постоянно, то такое ее состояние называется фазовым равновесием. Условием фазового равновесия является равенство химического потенциала компонента в одной фазе его значению в любой другой фазе. µkα = µkβ, (4.1) где µkФ = µk0,Ф(T,p) + RTlnN kФ γkФ. Чтобы охарактеризовать состояние гетерогенной системы, необходимо знать температуру, давление и концентрацию компонентов в каждой фазе. Но если в системе установилось фазовое равновесие, то только часть этих переменных являются независимыми, так как концентрации компонентов в отдельных фазах связаны уравнением (4.1). Число независимых переменных, необходимое для описания равновесного состояния гетерогенной системы, называется вариантностью или числом термодинамических степеней свободы системы. Вариантность системы (ω) определяет также число независимых переменных, которые можно произвольно (в некоторых пределах) изменять, не нарушая состояния в системе, то есть не изменяя числа и вида фаз в ней. Вариантность системы зависит от числа компонентов и определяется правилом фаз Гиббса ω = K – Ф +2 – R – L, (4.2) где К – число компонентов; Ф – число фаз; R – число химических реакций в системе; L – число дополнительных уравнений связи между концентрациями компонентов. В данной работе рассматривается система без химических реакций и без дополнительных уравнений связи, которая в тоже время исследуется при постоянном давлении. Поэтому уравнение Гиббса будет иметь вид: ω = K – Ф +1. (4.3) Расчет Используя данное уравнение, рассчитываем вариантность системы по кривым охлаждения (рис.3) и диаграмме плавкости (рис.1). Расчет дан рядом с (рис.3) т. 1:К=1,Ф=1, w=1-1+1=1 т. 1¢: К=1, Ф=2, w=1-2+1=0 т. 1¢¢: К=1, Ф=1, w=1-1+1=1 т. 2: К=2,Ф=1 w=2-1+1=2 т. 2¢: К=2,Ф=2 w=2-2+1=1 т.2¢¢: К=2,Ф=3, w=2-3+1=0 т.2¢¢¢: К=2,Ф=2, w=2-2+1=1 т. 3: К=2,Ф=1, w=2-1+1=2 т. 3¢: К=2,Ф=3, w=2-3+1=0 т. 3'': К=2,Ф=2, w=2-2+1=1 т.4: К=2,Ф=1, w=2-1+1=2 т. 4¢: К=2,Ф=3, w=2-3+1=0 т. 4¢¢: К=2,Ф=2, w=2-2+1=0 т. 5: К=2, Ф=1, w=2-1+1=2 т.5': К=2,Ф=2, w=2-2+1=1 т.5'¢: К=2,Ф=3, w=2-3+1=0 т.5'¢¢: К=2,Ф=2, w=2-2+1=1 Вывод правила рычага. Массу кристаллов, выделившихся из расплава при его охлаждении, можно определить, используя правило рычага. Вывод этого правила приводим для точки О. Для этого составляем уравнение материального баланса по компоненту В при постоянной температуре. m m = mраствора + mкристаллов (5.2) Подставив уравнение (5.2) в уравнение (5.1), получаем (mраствора + mкристаллов ) Решаем последнее уравнение относительно массы кристаллов: mраствора mкристаллов [ φB(K) - φB(O) ] = mраствора [ φB(O) - φB(L) ] (5.4) Из получившегося уравнения составляем пропорцию: Расчет. Для точки О: КО=20, OL=45, mраствора=2-mкр mкр=2LO/(LO+OK) mкр=1,38 кг
Для точки О': К'О'=10 O'L'=17 mкр=2L’O’/(L’O’+O’K’) mкр=1,25 кг УРАВНЕНИЕ ШРЕДЕРА. Вывод уравнения. Рассмотрим равновесную систему, состоящую из двух фаз – жидкой и твердой. Пусть каждая фаза представляет реальный раствор. При фазовом равновесии Тж = Ттв = Т; рж = ртв = р; µk ж = µkтв. Химический потенциал компонента в каждой фазе зависит от температуры, давления и активности компонента µkж = µk 0,ж(T,p) + RTlnakж; (6.1) µkтв = µk 0,тв(T,p) + RTlnakтв; (6.2) Где µk 0,ж(T,p) и µk 0,тв(T,p) – химические потенциалы чистого компонента в жидком и твердом состояниях при заданных температуре и давлении; аkж и аkтв – активности компонентов в равновесных фазах. Учитывая (6.1) и (6.2), уравнение (4.1) можно преобразовать к виду
При постоянных температуре и давлении
Из (6.4) следует, что отношение активностей компонентов в равновесных фазах при постоянных температурах и давлении – закон фазового равновесия. Если при заданных температуре и давлении добавить в одну из фаз некоторое количество компонента k, то это вызовет его перераспределение между фазами таким образом, что отношение активностей компонентов при вновь установившемся равновесии сохранится прежним. При изменении температуры или давления система перейдет в другое равновесное состояние, в котором изменится отношение активностей компонента в равновесных фазах и произойдет смещение равновесия. Рассмотрим, как изменение температуры при постоянном давлении влияет на изменение состава равновесных фаз. Для этого выразим в уравнении (6.3) активности через мольные доли
Полученное уравнение продифференцируем по температуре
Согласно уравнению Гиббса-Гельмгольца
где
Использовав уравнение (6.7), получим
Последнее уравнение в дифференциальном виде описывает влияние температуры на состав равновесных фаз при изобарном смещении равновесия, при переходе из равновесного состояния при одной температуре в равновесное состояние при другой температуре. Твердые растворы образуют компоненты, близкие по химическим и физическим свойствам и имеющим одинаковый тип кристаллической решетки. Если компоненты в твердой фазе не растворимы друг в друге, то из жидкого раствора выделяются кристаллы чистого вещества. В этом случае имеет место равновесие: жидкий двухкомпонентный раствор и кристаллы одного из компонентов (Nkтв =1, γkтв =1), а уравнение принимает вид
Проинтегрируем это уравнение, допустив, что
Здесь
Последнее уравнение носит название уравнения Шредера, в котором Из уравнения Шредера следует, что в случае идеальных растворов растворимость компонентов возрастает с увеличением температуры. Применение. Уравнение Шредера может быть использовано для решения различных задач: 1. Если известна температура кристаллизации чистого компонента и температура кристаллизации расплава заданного состава, то из уравнения (6.11) можно рассчитать мольную теплоту плавления компонента k:
2. Если мольная теплота плавления компонента известна, уравнение (6.11) можно решить относительно
3. Расчет понижения температуры кристаллизации компонентов из расплавов разного состава – Запишем уравнение (6.11) для компонента А:
Из уравнения (6.14)
Для разбавленных растворов (Nkтв →1, γkтв →1),
В разбавленных растворах
Величина, стоящая в уравнениях (6.15) и (6.16) перед величинами, выражающими состав раствора. Называется криоскопической постоянной, которая зависит только от свойств компонента А.
Расчеты. БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Киселева Е.В., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Учеб. Пособие для хим.-технол. вузов.- 5-е изд., перераб. и доп. – М.:Высш. шк., 1983.- 456 с. 2. Курс лекций по физической химии (доцент Урицкая А.А.). 3. Равновесие «Жидкий раствор (расплав) – кристаллы» в двухкомпонентной системе: методические указания к курсовой работе по физической химии/ Т.П.Большакова, А.А. Урицкая, Н.С. Кожевникова. Екатеринбург: ГОУ ВПО УГТУ-УПИ,2005.-16с.
КУРСОВОЙ ПРОЕКТ По теме: Равновесие «Жидкий раствор (расплав) – кристаллы» в двухкомпонентной системе Вариант 4
Выполнил: студент гр. Мт-201301 Бражников Н.А. Преподаватель: Урицкая А.А.
Екатеринбург 2012 СОДЕРЖАНИЕ
1. Задание для курсового проекта 1.1. Условие задачи 1.2. Исходные данные 2. Пересчет мольных долей в массовые для компонента А. Построение изобарной диаграммы в координатах Т-φА
3. Описание диаграммы плавкости по областям 4. Кривые охлаждения 4.1. Правило фаз Гиббса 4.2. Расчет 5. Определение массы кристаллов 5.1. Вывод правила рычага 5.2. Расчет 6. Уравнение Шредера 6.1. Вывод уравнения 6.2. Применение 6.3. Расчеты 6.3.1. Расчет мольных теплот плавления веществ А и В 6.3.2. Расчет температур начала кристаллизации компонентов А и В 6.3.3. Расчет коэффициентов активности компонентов А и В 6.3.4. Расчет криоскопических постоянных веществ А и В 7.Библиографический список 8. Приложение
ЗАДАНИЕ ДЛЯ КУРСОВОГО ПРОЕКТА Условие задачи 1. Данные эксперимента для каждого варианта должны быть взяты из табл. «Зависимость температуры начала кристаллизации расплава от его состава (в мольных долях)». По этим данным построить изобарную диаграмму (T – NA). 2. Выведите уравнение для пересчета мольных долей в массовые для компонента А. Представьте в табличной форме результаты пересчета мольных долей (NА) в массовые доли (φА) и постройте изобарную диаграмму в координатах T - φА. 3. Опишите диаграмму плавкости по областям. 4. Начертите все типы кривых охлаждения (кривые в координатах «температура – время» и опишите их, опираясь на правило фаз Гиббса). 5. Выведите уравнение для расчета масс равновесных фаз (правило рычага) в областях диаграммы (T - φА), где находятся: а) кристаллы компонентов А – расплав; б) кристаллы компонентов В – расплав. 6. Рассчитайте массу выделившихся кристаллов при охлаждении 2кг расплава. Состав расплава задается преподавателем. 7. Выведите уравнение Шредера и рассчитайте мольные теплоты плавления веществ А и В в приближении совершенного раствора (Nk → 1). 8. Рассчитайте, используя уравнение Шредера, температуры начала кристаллизации компонентов А и В из расплавов разного состава. Сравните экспериментальные кривые кристаллизации (диаграмма T – NA) с рассчитанными. 9. Рассчитайте коэффициенты активности компонентов А и В в растворах с NA=70% и NB=67.5%. 10. По понижению температур начала кристаллизации веществ А и В из растворов состава NA=70% и NB=67.5% определите значение криоскопической постоянной веществ А и В по экспериментальным данным. Исходные данные
Для решения задачи были получены следующие данные: двухкомпонентная система представляет собой расплав солей Li2CO3 (вещество А) и K2CO3 (вещество В). Этим веществам соответствуют молярные массы МА=73.89•10-3 кг/моль, МВ=138•10-3 кг/моль. Зависимость температуры начала кристаллизации раствора от состава раствора приведена в табл. 1.1. Таблица 1.1.
По приведенным данным строим изобарную диаграмму зависимости температуры начала кристаллизации системы от состава в координатах Т – NA (рис.1). ПЕРЕСЧЕТ МОЛЬНЫХ ДОЛЕЙ В МАССОВЫЕ Массовая доля вещества в двухкомпонентной системе представляет собой отношение массы этого вещества к общей массе системы.
Разделив это уравнение на массу компонента А, получаем
Представив массу компонента в виде произведения молярной массы компонента на число молей, получаем
Мольная масса компонента в двухкомпонентной системе представляет собой отношение числа молей компонента к общему числу молей системы.
Следовательно, отношение мольных долей компонентов равно отношению числа молей соответствующих компонентов.
Подставив уравнение (2.5) в уравнение (2.3), получаем формулу для пересчета мольной доли компонента в массовую:
Результаты пересчета приведены в табл. 2.1. Таблица 2.1.
По полученным данным строим изобарную диаграмму в координатах Т -
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 2204; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.154.41 (0.122 с.) |
 (2.1)
(2.1) (2.2)
(2.2) (2.3)
(2.3) (2.4)
(2.4)
 (2.5)
(2.5)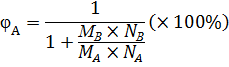 (2.6)
(2.6) A,%
A,%
 A (рис.2).
A (рис.2). φB(O) = mраствора
φB(O) = mраствора 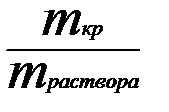 =
=  ;
; (5.5)
(5.5) (6.3)
(6.3) (6.4)
(6.4) (6.5)
(6.5) (6.6)
(6.6) (6.7)
(6.7) – изменение химического потенциала чистого компонента при переходе из твердого состояния в жидкое;
– изменение химического потенциала чистого компонента при переходе из твердого состояния в жидкое; – мольная теплота плавления компонента.
– мольная теплота плавления компонента. . (6.8)
. (6.8) (6.9)
(6.9) не зависит от температуры
не зависит от температуры
 (6.10)
(6.10)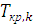 и
и 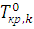 – температуры кристаллизации чистого компонента из раствора и температура кристаллизации чистого вещества. Уравнение (6.10) в интегральной форме описывает влияние температуры на равновесие «жидкий раствор – кристаллы компонента». Если жидкая фаза близка по свойствам к идеальному раствору (γkж =1), то уравнение (6.10) записывается в виде
– температуры кристаллизации чистого компонента из раствора и температура кристаллизации чистого вещества. Уравнение (6.10) в интегральной форме описывает влияние температуры на равновесие «жидкий раствор – кристаллы компонента». Если жидкая фаза близка по свойствам к идеальному раствору (γkж =1), то уравнение (6.10) записывается в виде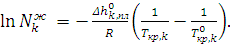 (6.11)
(6.11) – мольная доля компонента в жидком растворе, находящемся в уравнении с его кристаллами, то есть концентрация компонента в насыщенном растворе или растворимость компонента k при температуре
– мольная доля компонента в жидком растворе, находящемся в уравнении с его кристаллами, то есть концентрация компонента в насыщенном растворе или растворимость компонента k при температуре 
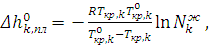 (6.12)
(6.12)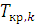 температуры, при которой из расплава начинают выделяться кристаллы компонента k:
температуры, при которой из расплава начинают выделяться кристаллы компонента k: (6.13)
(6.13) :
: (6.14)
(6.14) (6.15)
(6.15)

 (6.15)
(6.15) , поэтому последнее уравнение можно записать, используя d-шкалу
, поэтому последнее уравнение можно записать, используя d-шкалу (6.16)
(6.16)





