
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет эксергии и ее составляющих
Методику расчета эксергии можно разделить на две группы. Первая – это расчет изменения эксергии при физических и химических процессах; вторая – это определение уровней отсчета эксергии (параметров окружающей среды при расчете эксергии). Изменение эксергии при физических и химических процессах. Расчет эксергии удобнее вести в удельных величинах. В общем случае эксергия является функцией параметров состояния (температура, давление и состав среды):
Приращение эксергии моля вещества при изменении температуры, давления и состава составляет:
При таком разделении эксергий можно при расчете термомеханической составляющей обойтись без знания значений эксергий чистых компонентов, но необходимо знать свойства смесей. Термическая составляющая эксергии. Дифференцируя по температуре уравнение:
получим:
Т.к.:
При постоянной теплоемкости системы получим:
Это уравнение позволяет определить изменение эксергии при нагревании или охлаждении рабочего тела. Если теплоемкость среды сильно зависит от температуры, используется уравнение:
При осуществлении процессов испарения или конденсации, а также плавления или кристаллизации из расплава, будем иметь (процессы проходят при постоянной температуре среды):
Эксергия давления - механическая. Дифференцируем по
Значения производных в уравнении равны:
После подстановки значений производных, получаем:
В том случае, когда рабочее тело- идеальный газ, имеем:
Тогда:
После интегрирования получим:
Если газовая смесь неидеальна и описывается уравнением со вторым вириальным коэффициентом: V = RTp-1 + B, то Химическая эксергия. В химических процессах изменение эксергии происходит за счет протекания химических реакций (теплота химических превращений), физических явлений (растворение, кристаллизация и др.) и за счет изменения состава смеси. Поэтому эксергия химических превращений (тепловой эффект химических реакций) и физических явлений (растворение, кристаллизация и др.) аналогична термической эксергии при фазовых превращениях. А эксергия, обусловленная изменением состава, аналогична эксергии давления, т.к. изменение состава проявляется в изменении парциального давления компонентов в смеси (для газовой смеси) и мольной доли для смеси жидкой.
Расчет изменения эксергии при образовании и разделении смесей удобно вести через парциальные мольные эксергии. После дифференцирования уравнения () по числу i - го молей компонента получаем уравнение, характеризующее связь изменения эксергии с изменением ее парциальной доли компонента:
Химический потенциал компонента:
Поэтому
Таким образом, химическая составляющая эксергии равна:
Первое слагаемое уравнения отражает влияние теплоты химического и (или) фазового превращения на эксергию и является аналогом термической составляющей эксергии eT. В него входит интегральная теплота превращения
Второе слагаемое является аналогом эксергии давления ep и характеризует зависимость эксергии от летучести компонентов при изменении ее состава. Можно убедиться, что для идеальных газов при равновесии, когда:
Это соотношение используется для расчета изменения эксергии и в жидких средах. Таким образом, принципиального отличия в расчете изменения химической составляющей эксергии и термомеханической составляющей эксергии формально не существует. Уравнение () нужно использовать для расчета эксергии в полном виде только в тех случаях, когда температура и общее давление системы изменяется в результате протекания химической реакции и независимого от нее изменения температуры и давления. Изложенное выше относится к расчету изменения эксергии при химических и фазовых превращениях, но не дает возможности рассчитать полное значение эксергии, т.к. во все уравнения входит величина e0. Эта величина равна нулю в состоянии, соответствующем условиям отсчета эксергии. Если для термомеханической эксергии и эксергии давления это состояние найти легко, то для химической эксергии это представляет некоторые трудности.
|
||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 947; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.221.204 (0.006 с.) |
 (26)
(26) (27)
(27) – механическая эксергия давления;
– механическая эксергия давления;  – термическая эксергия;
– термическая эксергия;  – химическая эксергия. Сумма:
– химическая эксергия. Сумма: – термомеханическая или физическая эксергия.
– термомеханическая или физическая эксергия. , (28)
, (28) . (29)
. (29) и
и  , то после подстановки в уравнение () получим
, то после подстановки в уравнение () получим . (30)
. (30) (31)
(31) . (32)
. (32) . (33)
. (33) уравнение (), получаем:
уравнение (), получаем: . (34)
. (34)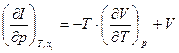 , и
, и  . (35)
. (35) . (36)
. (36)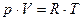 и
и  ,
,  . (37)
. (37)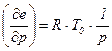 . (38)
. (38) . (39)
. (39) . (40)
. (40) . (41)
. (41) . (42)
. (42)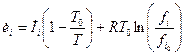 . При невысоких давлениях, когда fi» pi:
. При невысоких давлениях, когда fi» pi: . (43)
. (43) . (44)
. (44) :
: . (45)
. (45) , справедливо соотношение:
, справедливо соотношение: . (46)
. (46)


