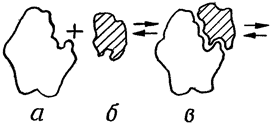Содержание книги
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение ферментов и коферментов ⇐ ПредыдущаяСтр 4 из 4
Форма белковых молекул В зависимости от третичной структуры белки могут иметь нитевидную (фибриллярную) и шарообразную (глобулярную) форму. Фибриллярные белки являются структурным или сократительным материалом организма. Например, коллаген входит в состав сухожилий, хрящей, кожи и принимает участие в образовании скелета, а миозин является сократительным белком мышц. Эти белки не растворяются в воде. Глобулярные белки способны легко передвигаться и проникать через стенки кровеносных капилляров. Они растворяются в воде и содержатся в жидких средах организма. Глобулярными являются белки иммунной системы (антитела), сократительный белок мышц актин, все ферменты, а также гемоглобин, миоглобин и многие другие белки. Глобулярные белки могут превращаться в фибриллярные. Такое изменение формы белка влияет на его свойства (растворимость, специфическую функцию). Глобулярные белки при переходе в фибриллярные становятся нерастворимыми и плохо перевариваются, а ферменты теряют каталитическую функцию. Свойства белков Проявление биологической активности белков зависит не только от строения их молекул, но и от химических свойств. Основными физико-химическими свойствами белков являются: молекулярная масса, растворимость в воде, способность образовывать гели, денатурация, амфотерность, буферное действие и др. Молекулярная масса белков колеблется от 6000 до нескольких миллионов дальтон. Так, молекулярная масса гормона инсулина составляет 5733, рибонуклеазы (фермента, расщепляющего РНК) — 12 640, миоглобина (белка мышц) — 17 000, гемоглобина — 64 500, глобулина сыворотки крови — 176 000, миозина (белка мышц) — 493 000. Масса белковых молекул влияет на скорость их передвижения в биологических жидкостях. Растворимость большинства белков в воде осуществляется благодаря способности связывать воду: она увеличивается при небольших концентрациях нейтральных солей и уменьшается при их высоких концентрациях. Водные растворы белков представляют собой коллоиды. Способность образовывать гели или сгустки имеет большое физиологическое значение, поскольку придает им высокую упругость или эластичность (белки коллаген и эластин, актомиозиновый комплекс). Гели — это структурные объединения белков (сетки), в которых внутреннее пространство заполнено большим количеством воды.
Коагуляция (от лат. coagulatio — свертывание, сгущение) — это укрупнение частиц в коллоидных системах, которое может сопровождаться образованием коагулянта (плотного сгустка). Иногда это приводит к образованию сплошных объемных структур (желатинирование). Денатурация — это нарушение нативной структуры белков под воздействием различных факторов, приводящее к потере его биологической активности. Денатурация наблюдается при нагревании, изменении рН среды, ультрафиолетовом и ионизирующем облучении, механическом воздействии солей тяжелых металлов, спирта, ацетона. При быстром удалении денатурирующих факторов белок может вернуться в нативное состояние (ренатурировать) с восстановлением его биологической функции. Амфотерные свойства белков проявляются благодаря наличию свободных -NH2 и Нуклеиновые кислоты
Живые организмы обладают способностью воспроизводить себе подобных. Явление передачи наследственной информации из поколения в поколение связано с нуклеиновыми кислотами. О существовании нуклеиновых кислот известно уже свыше ста лет, однако только в последние десятилетия полностью определена огромная роль этих соединений. Впервые они были выделены швейцарским врачом Ф. Мишером (1868 г.) из ядер клеток и названы нуклеинами {от лат. nucleus — ядро). Позже было установлено, что нуклеины присутствуют также в митохондриях, рибосомах, цитоплазме. Ф. Мишер определил, что в состав нуклеина входят атомы углерода, водорода, кислорода, азота и фосфора. Только в 1889 г. Р. Альтман показал, что нуклеин имеет кислые свойства и предложил назвать эти соединения нуклеиновыми кислотами.
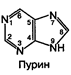
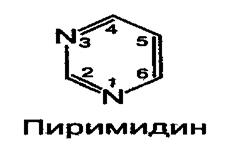
Нуклеиновые кислоты имеют более сложную структуру, чем белки. Это одни из наиболее крупных молекул, известных человеку, с молекулярной массой в несколько десятков или сотен миллионов. Именно в этих макромолекулах и содержится информация, которая необходима клетке для образования всех белков, так как сходство и различие организмов в конечном итоге определяются набором белков. Следовательно, нуклеиновые кислоты представляют генетический материал живых клеток, который передается из поколения в поколение при их репродукции, благодаря чему потомки способны синтезировать те же белки, что и их предки. Выяснение структуры нуклеиновых кислот открыло новую эпоху в биологии, так как позволило понять, каким образом живые клетки, а следовательно, и организм точно воспроизводят себя и как в них кодируется информация, необходимая для регулирования их жизнедеятельности. Нуклеиновые кислоты — это высокомолекулярные соединения, состоящие из большого количества связанных между собой мононуклеотидов. Их можно рассматривать как полимеры нуклеотидов подобно полисахариду гликогену — полимеру глюкозы. Химический состав нуклеиновых кислот. При полном гидролизе нуклеиновых кислот образуется несколько простых низкомолекулярных органических веществ, таких как азотистые основания и углеводы, а также молекулы фосфорной кислоты. Азотистые основания нуклеиновых кислот являются производными гетероциклического азотсодержащего соединения пурина (пуриновые основания) или пиримидина (пиримидиновые основания). К пуриновым основаниям относятся аденин (А) и гуанин (Г), а к пиримидиновым — цитозин (Ц), тимин (Т) и урацил (У). Их молекулы различаются наличием определенных функциональных групп: -NH2, -ОН, -СН3. Из пяти азотистых оснований каждая нуклеиновая кислота включает только четыре — два пуриновых и два пиримидиновых.
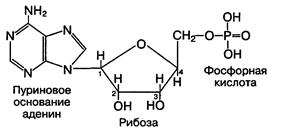
Каждый мононуклеотид, кроме азотистого основания, включает остаток углевода (рибоза или дезоксирибоза) и фосфорную кислоту. В зависимости от углевода полинуклеотиды (нуклеиновые кислоты) называют рибонуклеиновыми - РНК или дезоксирибонуклеиновыми - ДНК.
Мононуклеотид РНК – аденозинмонофосфорная кислота имеет следующее строение:
[ Фосфорная кислота входит в состав всех нуклеиновых кислот в большом количестве. Чаще всего она соединена с углеводным компонентом по гидроксильной группе при пятом углеродном атома рибозы или дезоксирибозы. Нуклеозиды и нуклеотиды. При неполном гидролизе нуклеиновых кислот образуются нуклеозиды и молекулы фосфорной кислоты, а также нуклеотиды. Нуклеозид — это соединение, в котором азотистое основание связано с углеводом — рибозой или дезоксирибозой. Их название образуется от названия азотистого основания (например, соединение аденина с рибозой — аденозин). Структурной единицей нуклеиновых кислот является нуклеотид. Нуклеотиды состоят из трех компонентов: пуринового или пиримидинового основания, углевода рибозы или дезоксирибозы, которые соединены между собой и составляют нуклеозид, и остатка фосфорной кислоты, присоединенной к гидроксилу пятого атома углерода в молекуле углевода. Примером нуклеотида может служить аденозинмонофосфорная кислота (аденозинмонофосфат), или адениловая кислота.
. Молекулы отдельных нуклеиновых кислот могут включать от 70 до 5—50 тыс. нуклеотидов. В зависимости от количества остатков фосфорной кислоты в нуклеотиде выделяют нуклеотидмонофосфаты, нуклеотиддифосфаты, нуклеотидтрифосфаты. Нуклеиновые кислоты состоят из нуклеотидмонофосфатов, но при их синтезе используются нуклеотидтрифосфаты. 2. Структура, свойства и биологическая роль ДН К Молекула ДНК имеет очень большую молекулярную массу — от нескольких миллионов до 2—5 миллиардов, так как состоит из 50 тысяч и более нуклеотидов. В состав ДНК входят углевод дезоксирибоза и азотистые основания — аденин, гуанин, цитозин и тимин. Нуклеотиды соединяются между собой 3', 5'-фосфодиэфирными связями, образуя полинуклеотидную цепь. Молекулы ДНК — это двухцепочные структуры, которые несут в себе сразу два "текста", но заключенная в них информация одна и та же, поскольку каждому нуклеотиду в одной нити отвечает лишь один определенный нуклео-тид в другой, т.е. два текста однозначно соответствуют друг другу- В этом соответствии заключен принцип комплементарности. Это означает, что в строго упорядоченной двойной спирали пространственные возможности таковы, что против А может стоять только Т, а против Г — только Ц. Нуклеотидный текст ДНК — это две комплементарные друг другу строчки. Каждая из них может считываться копирующим ферментом только в одном направлении. Если одна строчка читается слева направо, то другая — справа налево. Нуклеотидный состав ДНК разных видов организмов может варьировать в зависимости от сумм комплементарных азотистых оснований: Каждый орг-м имеет характерную только для него молекулу ДНК с определенным количественным составом и последовательностью нуклеотидов, кото.рые в любых физиологических состояниях сохраняются. Нарушение их приводит к мутациям, вызывающим паталогические изменения в организме. Структура ДНК. Нуклеотиды в полимерной цепи молекулы ДНК располагаются в строго определенной последовательности, характерной для каждого вида организмов. Такое расположение нуклеотидов называется первичной структурой. Вторичная структура молекулы ДНК, согласно модели американских биохимиков Уотсона и Крика, представляет собой двойную спираль. Схематически она напоминает винтовую лестницу, перила которой образованы основной цепью из углеводных и фосфатных групп, в то время как азотистые основания между двумя цепями образуют "ступени". Азотистое основание одной полинуклеотидной цепи связано с основанием другой с помощью водородных связей таким образом, что две половинки ступеней образуют довольно прочное соединение. Последовательность азотистых оснований А-Т и Г-Ц одной цепи полностью комплементарна последовательности другой цепи. В такой структуре каждая пара оснований удалена друг от друга на 3,4 нм, что соответствует одному витку спирали из десяти нуклеотидов.
Третичная структура молекул ДНК на некоторых участках может подвергаться дальнейшей пространственной укладке в суперспираль, приобретая структуру в виде кольца. Третичная структура образуется благодаря белкам, которые входят в нуклеопротеидный комплекс хромосом. Суперспиральная структура обеспечивает экономную упаковку огромной молекулы ДНК. Так, в хромосоме человека молекула ДНК настолько уплотнена, что ее длина укладывается в 5 нм, хотя истинная ее длина достигает примерно 8 см. Свойства ДНК. Структура молекулы ДНК такова, что может раскручиваться за счет разрыва водородных связей и самоудваиваться. Процесс самовоспроизведения молекулы ДНК называется репликацией (рис. 82). Он обеспечивает точное воспроизведение генетической информации в виде синтезирующейся комплементарной цепи ДНК и передачу этой информации следующему поколению в процессе деления клетки. При этом отдельные нуклеотидные цепи ДНК расходятся полностью или только на отдельных ее участках, а на них, как на матрице, происходит синтез комплементарной цепи новой молекулы ДНК. Для процесса репликации ДНК в клетках, кроме наличия ДНК-матрицы, необходимы структурные ее компоненты: дезоксинуклеотидтрифосфа-ты (АТФ, ГТФ, ЦТФ, ТТФ и др.), а также специфические ферменты репли-кационной системы, которые называются ДНК-полимеразами. Биологические свойства ДНК зависят не только от нуклеотидного состава, но и от специфической последовательности нуклеотидов в полинуклеотидной цепи ДНК, что определяет структуру генома, т. е. все количество ДНК в клетке, несущее генетическую информацию об организме. Биологическая роль ДНК. Все признаки организма проявляются через свойства синтезирующихся в нем белков. Состав и структура каждого белка закодированы в отдельных участках молекулы ДНК, которые называются генами. Таким образом, основная функция ДНК — хранение и передача наследственной или генетической информации. Ген — это участок ДНК, на котором закодирована аминокислотная последовательность, характерная для каждого конкретного белка. Ген является функциональной единицей наследственности и определяет тот или иной признак организма, поэтому информация, содержащаяся в ДНК, называется генетической. Установлено, что не все количество ДНК связано с хранением генетической информации. У высших организмов только незначительная часть ДНК (около 2 %) является носителем генетической информации, а большая ее часть выполняет различные регуляторные функции. Количество ДНК, которое несет генетическую информацию данного организма, называют геномом.
Передача генетической информации в ходе синтеза белка осуществляется генетическим кодом. Место включения каждой аминокислоты в молекуле синтезирующегося белка закодировано в виде определенной последовательности нуклеотидов в ДНК. Генетический код — это определенная последовательность азотистых оснований нуклеотидов данного гена, соответствующая последовательности аминокислот в белке. Каждая аминокислота кодируется тремя азотистыми основаниями, расположенными в определенной последовательности — триплетом, который называется кодовом. Большинство аминокислот, кроме ме-тионина и триптофана, может кодироваться несколькими кодонами. Кодоны 20 аминокислот представлены в табл. 17. Указанные кодоны различаются только третьим азотистым основанием. Например, кодирование аминокислоты аланина осуществляется четырьмя триплетами нуклеотидов — ГЦУ, ГЦЦ, ГЦА, ГЦГ. Главную роль при узнавании аминокислоты играют первые два основания. Не все кодоны кодируют аминокислоты. Некоторые из них служат "стартовыми" сигналами, запускающими синтез полипептидной цепи белка, как, например, АУГ — кодон метионина. Другие кодоны, например УАА, УАГ и УГА, выполняют функцию прекращения синтеза белка (кодоны терминации). В молекуле ДНК присутствуют также коды, участвующие в запуске процесса репликации ДНК, синтеза РНК, связывания с молекулами — регуляторами этих процессов. Генетический код универсален для всех живых организмов, так как каждая из 20 аминокислот у них кодируется одним и тем же триплетом нуклеотидов. При нарушении последовательности нуклеотидов в структуре гена появляются ошибки в синтезе соответствующего белка, что ведет к нарушению его функции в организме (мутационные изменения). Так, мутационные изменения в молекуле гемоглобина, вызванные заменой всего двух из почти шестисот аминокислот, приводят к заболеванию - серповидной анемии. Такая молекула гемоглобина теряет растворимость, в результате чего образуется волокнистый осадок, который деформирует эритроцит и придает ему форму серпа. Серповидные эритроциты быстро разрушаются, что приводит к хронической гемолитической анемии. Количественное содержание и локализация ДНК в клетке зависят от ее функций. Наибольшее ее количество сосредоточено в сперматозоидах — до 60 % сухой массы, в других клетках организма — около 1—10 %, в мышцах — до 0,2 %. В клетке ДНК сосредоточена преимущественно в ядре (до 30 % сухой массы), где связана с белками и хромосомами. Незначительное количество ДНК (до 1—3 %) локализовано в митохондриях. Эти ДНК отличаются от ядерной ДНК составом и молекулярной массой. Митохондриальная ДНК не связана с белками, содержит до 15 генов, обусловливающих цитоплазматическую наследственность. В ней кодируются некоторые типы митохондриальных РНК и полипептидов. Структура, свойства и биологическая роль РНК Рибонуклеиновые кислоты представляют собой полинуклеотидные цепи, в которые входит около 6 тысяч нуклеотидов. Они имеют небольшую молекулярную массу (до двух миллионов). Углеводным компонентом РНК является рибоза. Из азотистых оснований в состав РНК входят аденин, гуанин, цитозин, урацил. РНК человека, в отличие от ДНК, состоит из одной полинуклеотидной цепи с отдельными спирализованными участками. Двухцепочечные молекулы РНК встречаются только у некоторых вирусов. Первичную структуру РНК, как и ДНК, составляет определенная последовательность чередования нуклеотидов в полинуклеотидной цепи. Связь между ними осуществляется через остаток фосфорной кислоты. Разные виды РНК отличаются составом нуклеотидов, их количеством и последовательностью расположения. Вторичная структура РНК зависит от вида РНК и функционального состояния клетки. Молекулы РНК могут располагаться более компактно, поскольку взаимодействие между основаниями приводит к образованию дополнительных складок, что определяет третичную структуру РНК. Согласно модели, предложенной Холли, вторичная структура транспортной РНК напоминает клеверный лист. В клетке всегда присутствуют три вида РНК, которые различаются локализацией, молекулярной массой, нуклеотидным составом, структурой и биологическими функциями. К ним относятся транспортная, информационная и рибосомальная РНК. Транспортная РНК (тРНК) составляет 10—20% всей РНК клетки, состоит из 75—90 нуклеотидов и имеет молекулярную массу от 23 до 30 тысяч. Находится она в цитоплазме клеток и осуществляет перенос аминокислот к рибосомам, где происходит синтез белка. В клетке обнаружено около 60 различных тРНК. Каждой из 20 аминокислот соответствует несколько разных тРНК. Молекула тРНК благодаря уникальному строению (в виде клеверного листка) взаимодействует не только с аминокислотами, но и с белками-ферментами, а также с иРНК на рибосомах. На одном конце молекулы тРНК находится одинаковый для всей тРНК триплет ЦЦА-ОН, по которому присоединяются аминокислоты, а на противоположном конце расположен участок антикодон, комплементарный триплету (кодону) в молекуле иРНК. С помощью антикодона тРНК "узнает" свое место присоединения аминокислоты к синтезирующемуся белку. Информационная, или матричная РНК (иРНК или мРНК) составляет 3— 5 % всей клеточной РНК. Молекула иРНК содержит до 6000 остатков нуклеотидов и имеет молекулярную массу от 500 тысяч до 2 миллионов. Она очень быстро синтезируется (1 молекула за 25 с) и распадается (в течение 3—5 мин). Синтезируется иРНК на участке молекулы ДНК — гене как на матрице и переносит генетическую информацию о последовательности аминокислот в белках от молекул ДНК из ядра к местам их синтеза — в рибосомы. В клетке находятся разнообразные формы иРНК, которые осуществляют синтез тысяч различных белков, строение которых закодировано в специфической структуре иРНК. Рибосомальная, или структурная РНК (рРНК, сРНК) составляет до 80 % всей клеточной РНК и имеет молекулярную массу 0,5—2 миллиона. Она находится в рибосомах, где происходит синтез белка, и в соединении с соответствующими белками образует структуру рибосом, а также активирует процесс синтеза белка. В клетке РНК содержится в 5—10 раз больше, чем ДНК. Обнаружены РНК почти во всех клеточных структурах. Наибольшее их количество (60— 80 %) сосредоточено в рибосомах, наименьшее — в цитоплазме.
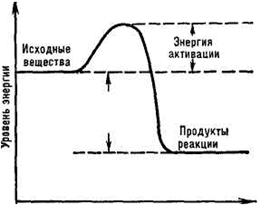
ФЕРМЕНТЫ Ферменты, или энзимы – это высокоактивные биологические катализаторы. Они изменяют скорость химической реакции, но сами после реакции возвращаются к исходному состоянию. С участием ферментов осуществляются практически все биохимические процессы в живых организмах, в которых постоянно происходит огромное число разнообразных химических реакций. Все клеточные структуры непрерывно обновляются. Благодаря ферментам, эти изменения протекают с огромной скоростью, в миллионы раз превышающей скорость подобных реакций в неживой природе. В то же время превращения в организме осуществляются при сравнительно низких температурах и давлении, в ограниченном диапазоне колебаний концентрации водородных и гидроксильных ионов. Например, распад белков пищи до аминокислот в пищеварительной системе человека происходит при температуре 37° за 2—3 ч, в то время как в лаборатории ту же реакцию можно провести лишь при температуре 100°, в присутствии крепких растворов кислот за несколько десятков часов. Ферменты могут находиться в жидкой части клетки (цитозоле) и отдельных клеточных органеллах (ядре, митохондриях, рибосомах, лизосомах и др.), а также входить в состав клеточных мембран. Ферменты широко используются в различных сферах деятельности человека. С незапамятных времен их применяли при изготовлении сыра, получении спирта, а также в хлебопечении, пивоварении, производстве антибиотиков, витаминов и т. д. Современная промышленность выпускает более 200 ферментативных препаратов, которые применяются в медицинской практике для профилактики и лечения различных заболеваний. Так, при заболеваниях желудочно-кишечного тракта применяются трипсин, химотрипсин, липаза и амилаза в виде ферментативных препаратов (бетацид, обомин, панзинорм и др.). Фермент гиалуронидазу в виде препаратов лидазы и ронидазы применяют при поражении суставов, отеках, ранениях, кровоподтеках. Лизоцим применяют при лечении конъюнктивитов, цитохромоксидазу — при кислородной недостаточности, коллагеназу — для рассасывания рубцовых образований, эластазу — для профилактики атеросклероза. При лечении различных заболеваний, в том числе опорно-двигательного аппарата, посттравматических изменений и др., используется метод системной энзимотерапии. Он основан на комплексном действии ряда полиферментных препаратов (вобэнзим, флогэнзим и др.) на многие биохимические процессы в организме. Ферменты используются также при диагностике функционального состояния организма в медицине и современном спорте. . По химической природе ферменты являются белками. Они образуют коллоидные растворы, имеют молекулярную массу от десятков тысяч до нескольких миллионов углеродных единиц, в растворах ведут себя как амфотерные электролиты и при изменении рН меняют величину электрического заряда молекул. Ферменты способны кристаллизоваться из растворов. Кристаллы ферментов содержат значительное количество воды, обладают высокой каталитической активностью. При обезвоживании кристаллы разрушаются, и ферменты утрачивают активность. Различают ферменты внутриклеточные и внеклеточные. Внутриклеточные ферменты проявляют свое действие в тех клетках тела, где они образуются. Они входят в состав сложных клеточных структур и могут создавать комплексы с другими ферментами, ускоряя таким образом протекание не единичной реакции, а биохимического процесса, включающего множество реакций. Внеклеточные ферменты выделяются из клеток в кровь, пищеварительные соки и другие биологические жидкости, где и ускоряют разнообразные превращения веществ. В настоящее время подробно изучено около 2000 ферментов. Как и белки, ферменты имеют сложную пространственную третичную и четвертичную структуру. Нативная (природная) структурная организация ферментов обеспечивает их каталитическую функцию. Нарушение ее под воздействием различных факторов приводит к потере активности ферментов. Ферменты подразделяют на простые и сложные. Простые ферменты состоят только из белка. Это многие ферменты пищеварительного тракта — амилаза, пепсин, трипсин. Сложные ферменты состоят из белковой части, которая называется апоферментом, и небелковой, которая называется кофактором. Молекулу сложного фермента часто называют холоферментом. Кофакторы, которые слабо связаны с белковой частью фермента, называются коферментами (коэнзимами). Кофермент может легко переходить от одного фермента к другому. Кофакторы, прочно связанные с белковой частью фермента, называются простетической группой. Кофакторами могут быть различные органические вещества и их комплексы, а также минеральные вещества. Многие из них термостабильны, но могут окисляться атмосферным кислородом. В организме человека ряд кофакторов не синтезируется, а поступает с продуктами питания. Их строение и участие в биологических процессах рассмотрено далее. В проявлении каталитической активности фермента принимает участие не вся его молекула, а только незначительная часть, которая называется активным центром. Активный центр — это часть молекулы фермента, которая взаимодействует с коферментом и субстратом и участвует в преобразовании вещества. Активный центр ферментов может быть образован несколькими функциональными группами отдельных аминокислот, расположенными в различных участках полипептидной цепи белка. Поэтому для проявления каталитической активности фермента важна его нативная структурная организация. При нарушении этой структуры изменяется активный центр, а значит, и активность фермента. Существуют ферменты, которые состоят из нескольких белковых молекул, т. е. имеют субъединичное строение. Они могут иметь несколько активных центров или единый центр, образованный при взаимодействии этих субъединиц. Кофакторы. Каталитическая активность сложных ферментов проявляется только в присутствии коферментов: Кофермент участвует в формировании активного центра фермента. Многие коферменты имеют сложное строение и включают витамины. Таким образом, регуляторное влияние витаминов на обмен веществ опосредовано через ферменты. Исходя из особенностей строения коферменты разделяют на две большие группы — витаминосодержащие и невитаминные Отдельные коферменты входят в состав продуктов повышенной биологической ценности, которые используются в практике спорта для улучшения механизмов энергообразования, ускорения процессов восстановления, специфического построения конституции тела, поэтому остановимся более подробно на их характеристике. Витаминосодержащие коферменты — никотинамидные, флавиновые, кофермент ацетилирования, тиаминпирофосфат, пиридоксалевые, кобаламидные и др. — различаются строением и выполняемыми функциями. Никотинамидные коферменты (НАД и НАДФ) в своем составе содержат витамин РР (никотинамид), флавиновые (ФМН и ФАД) — витамин В2 (рибофлавин). Это кофакторы ферментов дегидрогеназ, катализирующих процессы биологического окисления питательных веществ. Они играют роль акцепторов и переносчиков водорода: Кофермент ацетилирования (KoA-SH) содержит витамин В3 (пантотеновую кислоту), а также нуклеотид (АДФ) и р-меркаптоэтанол, содержащий SH-rpynny. Этот кофермент играет важную роль в обмене углеводов, липидов и белков. Он входит в состав ферментов, катализирующих пере-нос ацетильных остатков (СН3-СО-) в процессе распада углеводов и жир-ных кислот, а также синтеза жирных кислот, стероидов, ацетилхолина, превращения аминокислот. Тиаминпирофосфатный кофермент (ТПФ) содержит витамин В, (тиа-мин). Он является коферментом ферментов, которые катализируют декарбоксилирование (-СО2) пировиноградной и других кетокислот, регулируют распад и окисление углеводов. Пиридоксалевые и кобаламидные коферменты являются производными витамина В6 (пиридоксальфосфата) и витамина В12 (цианкобаламина) соответственно. Они входят в состав ферментов, которые катализируют превращение аминокислот и азотистых оснований, ускоряют процесс синтеза нуклеиновых кислот и белков. Биотин (витамин Н) является простетической группой фермента ацетил-КоА-карбоксилазы, которая участвует в биосинтезе жирных кислот. Белок авидин, который находится в куриных яйцах, способен связываться с биотином и ингибировать этот фермент. Убихиноновые коферменты (коферменты Q) являются производными жирорастворимых витаминов К и Е. Они участвуют в процессах тканевого дыхания и энергообразования. Невитаминными кофакторами могут быть нуклеотиды (АТФ, ГТФ, ИТф, УДФ, ЦДФ), гемсодержащие соединения, пептиды и многие металлы. Нуклеотиды и ионы металлов помогают ферменту или субстрату принять форму, необходимую для их взаимодействия. Гем является простетической группой цитохромов (компонентов дыхательной цепи), каталазы и других ферментов. Свойства ферментов Для ферментов характерны высокая каталитическая активность, специфичность действия и регулируемость их активности. Благодаря высокой каталитической активности ферментов скорость некоторых химических реакций увеличивается в миллионы раз. Примером может служить обратимая реакция синтеза и распада угольной кислоты, которую катализирует фермент карбоангидраза: СО2 + Н2О = Н2СО3. Одна молекула карбоангидразы эритроцитов способна связывать до 105 молекул СО2 в секунду, при этом скорость реакции в присутствии фермента увеличивается в 107 раз. Реакция синтеза Н2СО3 постоянно протекает в тканях организма при связывании метаболического СО2, а реакция распада Н2СО3 интенсивно протекает в капиллярах легких, где происходит выведение СО2 из организма при выдохе. Очень высокую активность проявляет каталаза, которая катализирует расщепление токсичного для организма вещества — перекиси водорода: 2Н2О2 -> 2Н2О + О2. При температуре 0° С одна молекула каталазы разлагает 40 000 молекул Н2О2 в секунду. Специфичность действия ферментов состоит в том, что фермент может катализировать превращение определенного субстрата или действовать на один из типов химических связей в нем. Благодаря этому в клетке множество химических реакций протекает одновременно в строго определенном порядке. Различают ферменты с абсолютной, относительной и групповой специфичностью. Абсолютная специфичность фермента проявляется в том, что он катализирует превращение молекул только одного субстрата. Например, фермент аргиназа способен катализировать распад только аргинина на мочевину и орнитин, а ферменты сахараза, мальтаза, лактаза способны расщеплять только соответствующие дисахариды. Относительной специфичностью действия обладают ферменты, которые катализируют разрыв определенного типа химической связи в молекулах разных веществ. Для них строение молекулы субстрата не имеет решающего значения. Относительная специфичность характерна для пептидаз пищеварительного тракта (пепсина, трипсина, химотрипсина), которые расщепляют пептидную связь в различных белках и пептидах, а также фосфатаз, липаз, которые расщепляют эфирные связи в молекулах различных веществ. Ферменты действуют только на один из нескольких изомеров субстрата. Групповая специфичность характерна для ферментов, которые действуют на субстраты с одинаковым типом связи и подобным строением молекул. Так, например, холинэстеразы расщепляют эфирную вязь во многих субстратах, которые содержат остаток холина. Регуляция процессов синтеза ферментов осуществляется на уровне генов и на уровне транскрипции (синтеза иРНК). Такие изменения наблюдаются при долговременном воздействии различных факторов среды, физических нагрузок и стероидных гормонов. Процессы адаптации организма к физическим нагрузкам взаимосвязаны с совершенствованием различных механизмов регуляции активности ферментов. При срочной адаптации к физическим нагрузкам изменяется активность уже существующих ферментов. При долговременной адаптации в организме усиливаются процессы синтеза белка, что приводит к увеличению количества ферментов. Такие изменения повышают адаптационные возможности обмена веществ. Благодаря регулируемости активности ферментов можно осуществлять коррекцию отдельных звеньев обмена веществ в организме, что является актуальной проблемой медицины и спорта. Большинство химических составных частей живого организма способно к множеству различных превращений. Фермент, ускоряя только одну какую-либо реакцию, препятствует всем побочным реакциям и тем самым определяет направление основного биохимического процесса. Скорость реакции зависит от строения молекул реагирующих веществ (реагентов), их концентрации, температуры, давления, наличия катализатора и некоторых других факторов. Реакция становится возможной только при столкновениях молекул. Чем больше молекул в единице объема, тем чаще они сталкиваются, т.е. скорость реакции повышается. Не каждое столкновение реагирующих молекул приводит к химической реакции. Чтобы реакция началась, молекулы должны обладать определенным запасом энергии, достаточным для преодоления энергетического барьера, который создается межмолекулярными силами отталкивания и внутримолекулярными силами сцепления (прочностью химических связей). Особенно большое количество энергии нужно для разрыва ковалентных связей, преобладающих в молекулах органических веществ. Когда энергетический барьер преодолен и реакция началась, в ходе ее может выделиться значительно больше энергии, чем затрачено на начало процесса. Изменения энергии, происходящие в ходе химических реакций, можно изобразить графически. Количество энергии, необходимое молю реагирующего вещества для вступления в реакцию, называется энергией активации и рассчитывается в кДж/моль.
Чем больше в веществе активных (возбужденных) молекул, способных преодолеть энергетический барьер, тем выше скорость его химических превращений. Запас энергии зависит от особенностей химического строения молекул и тех внешних воздействий, которым они подвергаются. В обычных условиях только незначительная часть молекул вещества находится в активном состоянии. Активация их происходит при нагревании вещества, передаче ему лучистой энергии (например, в фотохимических реакциях), столкновениях с другими, уже возбужденными молекулами или атомами. С повышением температуры на каждые 10° скорость реакции возрастает в среднем в 2—3 раза. Скорость реакции можно увеличить, повышая давление (если реагенты являются газами): активные молекулы сближаются, и частота столкновений между ними увеличивается. В живых организмах большие колебания температуры и давления невозможны. В них создаются условия, в которых для взаимодействия веществ требуется меньшая энергия активации. Это достигается снижением энергетического барьера реакции за счет уменьшения сил отталкивания между молекулами и ослабления химических связей.
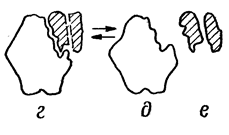
Согласно современным представлениям, механизм взаимодействия ферментов с субстратами связан с образованием нестойких ферментсубстратных комплексов В процессе образования фермент-субстратного комплекса в субстрате происходит перераспределение энергии, что приводит к разрыву или образованию химических связей. Так, например, энергия активации сахарозы при гидролитическом расщеплении без фермента составляет 134 кДж / моль"1 (25,6 ккал / моль"1), а в присутствии фермента (сахаразы) — только 39,3 кДж/моль"1 (8 ккал/ моль-1). Процесс взаимодействия фермента с субстратом протекает в несколько стадий, представленных на рис: • взаимодействие субстрата с активным центром фермента и образование ферментсубстратного комплекса; • преобразование первичного ферментсубстратного комплекса в другие ферментсубстратные комплексы, в ходе которых вещества переходят в активное состояние и далее распадаются на фермент и продукты реакции; • отделение продуктов реакции от активного центра фермента и диффузия их в окружающую среду. Сам фермент в ходе реакции не изменяется и может взаимодействовать с новыми молекулами субстрата.
а- фермент б- субстрат в- фермент-субстрат- е- продукты реакции ный комплекс
Факторы, влияющие на действие ферментов Скорость биохимических реакций, которая определяется по изменению концентрации реагирующих или образовавшихся веществ в единицу времени, зависит от активности ферментов и условий протекания реакции. Каждый фермент имеет свои оптимальные условия проявления активности. Оптимальными считаются условия, при которых ферментативная реакция протекает с максимальной скоростью. На скорость ферментативных реакций влияют: количество фермента; концентрация субстрата; активная реакция среды (рН); температура; присутствие активаторов и ингибиторов. Концентрация фермента и субстрата. Скорость ферментативной реакции увеличивается с увеличением количества фермента при высокой концентрации субстрата. В организме в состоянии относительного покоя многие ферменты не проявляют максимальную активность из-за низкой концентрации их субстратов. При мышечной деятельности усиливается энергетический обмен и накапливаются субстраты многих реакций, что способствует повышению активности многих ферментов. Активная реакция среды. Каждый фермент имеет узкий диапазон значений рН, при котором активность его максимальна. Большинство ферментов проявляют максимальную активность в организме при значениях рН, близких к 7,0, т. е. в нейтральной среде (рис. 39). Однако отдельные .ферменты проявляют высокую активность в сильно кислой среде, например пепсин (рН 2,0), сахараза (рН 4,5), или щелочной среде, например трипсин (рН 8,0), липаза (рН 9,0), аргиназа (рН 9,7). Влияние рН среды на активность ферментов связано с изменением степени ионизации их белковой молекулы под воздействием протонов Н или гидроксилов (ОН"), что в первую очередь влияет на структуру активного центра фермента. В организме человека в состоянии относительного покоя диапазон колебаний рН незначителен и ферменты «работают» в своих оптимальных режимах. При интенсивных физических нагрузках в мышцах накапливзетмолочная кислота, способная закислять среду и снижать активность многих ферментов. Температура. При повышении температуры от 0 до 40 °С активность Ферментов, как правило, повышается (рис. 40). Температурный коэффициент Q10 = 2, что указывает на повышение скорости ферментативной реакции в два раза при изменении температуры на 10 °С. Дальнейшее повышение температуры до 45—55 °С приводит к резкому снижению активности ферментов вследствие тепловой денатурации белка. Все ферменты имеют свою оптимальную температуру, при которой активность их максимальная (для многих ферментов оптимальной является температура 37— 40 °С). Однако имеются и термостабильные ферменты, например миокиназа, активность которой сохраняется при нагревании до 100 °С. При понижении температуры активность ферментов снижается. Тем не менее необратимая денатурация их не происходит, так как в условиях оптимальных температур их активность восстанавливается (примером может служить зимняя спячка животных). Это свойство ферментов используется при замораживании продуктов, а также органов и генетического материала, используемых для трансплантации. Активаторы и ингибиторы. Для ферментов характерна регуляция их активности специфическими низкомолекулярными веществами и ионами металлов, которые называют эффекторами, модуляторами или регуляторами ферментов. Одни из них способны снижать активность фермента (ингибиторы), другие — повышать ее (активаторы). Такой механизм контроля активности ферментов широко изучается, поскольку имеет большое практическое значение. В качестве активаторов могут выступать самые разнообразные вещества. Это прежде всего ионы двухвалентных металлов, таких как Mg2+, Zn2+, Mn2+, Co2+, Cu2+, Fe2+, Ca2+. Они вызывают обратимое изменение структуры активного центра. Так, карбоангидраза активируется ионами Zn2+, креатинкиназа — ионами Мg2+; АТФ-аза миозина мышц активируется ионами Са2+, для каталитической активности ферментов дыхательной цепи необходимы ионы Си2+ и Fe2+. Активация некоторых ферментов может осуществляться путем модификации их молекулы и не затрагивать активный центр фермента. Так, HCI активирует пепсиноген желудочного сока, переводя его из неактивной формы в активную (пепсин). Панкреатическая липаза активируется желчными кислотами. В качестве ингибиторов часто выступают вещества, близкие по строению к субстратам, которые связываются с активным центром фермента. Ингибирование бывает обратимое и необратимое. При обратимом ингибировании ингибитор легко отделяется от фермента и активность фермента восстанавливается. При необратимом ингибировании ингибитор прочно связывается с ферментом и закрывает доступ субстрата к активному центру. Процесс ингибирования широко используется для коррекции обменных процессов в медицине и других областях деятельности человека. Лечебный эффект ряда лекарственных препаратов обусловлен их ингибиторным действием на отдельные ферменты. Среди ингибиторов, которые обратимо ингибируют ферменты, выделяют конкурентные и неконкурентные ингибиторы. Конкурентные ингибиторы имеют структуру, подобную субстрату, и конкурируют с ним за место связывания в активном центре фермента. В случае конкурентного торможения ингибитор присоединяется к ферменту в том же участке, что и субстрат, в результате чего субстрат уже не может соединиться с ферментом. Конкурентное ингибирование обратимо и зависит от концентрации ингибитора и субстрата. При высокой концентрации субстрата такие ингибиторы неэффективны. Неконкурентные ингибиторы реагируют не с активным центром фермента, а с другой частью его молекулы. Это вызывает изменение структуры активного центра, что нарушает процесс катализа. Действие таких ингибиторов можно устранить только химическим изменением структуры их молекулы. К неконкурентным ингибиторам относятся ионы тяжелых металлов и их органические соединения (ртуть, свинец, мышьяк и многие яды), способные блокировать SH-группы в ферменте и нарушать или полностью подавлять обменные процессы в организме.
|
|||||||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 2; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.81.98 (0.022 с.) |

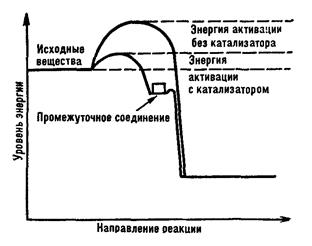 Основная функция ферментов – снижение величины энергетического барьера. Каталитическая реакция идет по иному пути, чем некаталитическая, — через стадию образования промежуточного соединения реагентов с катализатором. При адсорбции реагирующих молекул на поверхности катализатора силы взаимного отталкивания между ними ослабевают. Влияние электрического поля катализатора приводит к деформации молекул реагентов, смещению электронов в них и сильному ослаблению связей, в результате чего энергия активации понижается. Изменение энергии при каталитической реакции показано на рис.
Основная функция ферментов – снижение величины энергетического барьера. Каталитическая реакция идет по иному пути, чем некаталитическая, — через стадию образования промежуточного соединения реагентов с катализатором. При адсорбции реагирующих молекул на поверхности катализатора силы взаимного отталкивания между ними ослабевают. Влияние электрического поля катализатора приводит к деформации молекул реагентов, смещению электронов в них и сильному ослаблению связей, в результате чего энергия активации понижается. Изменение энергии при каталитической реакции показано на рис.