Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структурная организация белковСодержание книги
Поиск на нашем сайте
Органы и ткани Содержание белка, %
от сухой ткани от общего белка тела Скелетные мышцы 34,7 Кожа 11,5 Кости (твердые ткани) 18,7 Пищеварительный тракт 1,8 Мозг и нервная ткань 2,0 Печень 3,6 Сердце 0,7 Легкие 3,7 Селезенка 0,2 Почки 0,5 Поджелудочная железа 0,1 Жировая ткань 6,4 Остальные ткани:
жидкие 1,4 плотные 14,6 Все тело 100,0
Количественный и качественный состав отдельных белков различен. Все белки содержат постоянное количество азота, равное в среднем 16%. Поэтому по количеству азота, поступившего с пищей (процентное содержание азота пищи умножают на пересчетный коэффициент 6,25), определяют потребление белка организмом. Аминокислотный состав. Белки состоят из аминокислот. Известно около 200 различных аминокислот, однако для построения белков в животных и растительных тканях используются только 20. Называются эти аминокислоты основными. Наряду с основными в состав отдельных белков входят другие аминокислоты — неосновные. Каждая такая аминокислота происходит от одной из 20 основных аминокислот. Например, 4-гидроксипролин и 5-дигидро-ксилизин являются производными пролина и лизина и входят в состав коллагена — белка соединительной ткани: Простые и сложные белки. В зависимости от химического состава белки делятся на простые и сложные. Простые белки состоят только из аминокислот, среди которых есть растворимые в воде (гистоны, альбумины, фибриноген) и не растворимые (глобулины, миозин, коллаген, осеин, кератин). Сложные белки состоят из белковой и небелковой частей. Небелковая часть может быть представлена углеводами, нуклеиновыми кислотами, липидами, фосфорной кислотой, окрашенными (хромо-) веществами. В зависимости от природы небелковой части сложные белки делятся на гликопротеиды, нуклеопротеиды, липопротеиды, фосфопротеиды, хромопротеиды. Все они выполняют разнообразные функции в организме. Биологические функции белков • Структурная (пластическая). В комплексе с липидами белки составляют структуру всех клеточных мембран и основу цитоплазмы клеток. Структурной основой соединительной ткани являются такие белки, как коллаген (входит в состав хрящей и сухожилий), кератин (входит в состав кожи), эластин (входит в состав связок и стенок сосудов).
• Каталитическая. Эту функцию выполняют специфические белки-ферменты, регулирующие обмен веществ и энергии в организме. Если ферменты не работают в клетке, то биохимические реакции не протекают и живая клетка может погибнуть. • Сократительная. Все виды сокращения и движения скелетных мышц, миокарда и других сокращающихся тканей обеспечивают сократительные белки актин и миозин. • Транспортная. Белки способны связывать и транспортировать с током крови или через клеточные мембраны отдельные молекулы и ионы. Например, гемоглобин эритроцитов крови переносит кислород от легких к тканям и углекислый газ — от тканей к легким; миоглобин мышц переносит кисло род в мышечной ткани к местам его использования. Отдельные белки кро ви транспортируют жирные кислоты, липиды, железо, некоторые гормоны. • Защитная. Белки иммунной системы гаммаглобулины "узнают" и связывают чужеродные вещества, поступающие в организм, защищая тем самым его от вирусов, бактерий и клеток других организмов. Защитную функцию выполняет также белок интерферон. Белки плазмы крови фибриноген и тромбин участвуют в процессах свертывания крови, предотвращая кровопотери при ранениях. • Гормональная, или регуляторная. Высокоспецифические белки-гормоны регулируют обмен веществ. • Рецепторная. Многие белки являются рецепторами гормонов, нейро- медиаторов, других биологически активных веществ. Они осуществляют избирательное узнавание, связывание и передачу их регуляторного действия. • Передача наследственной информации. Белки входят в состав хромосом и участвуют в воспроизведении генетической информации, в регуляции процессов роста и размножения. • Опорная. Упругость и прочность костей скелета, кожи, сухожилий обеспечивают преимущественно белки коллаген и эластин. • Энергетическая. Около 10—15% энергопотребления организма обеспечивается белками. При окислении 1 г белков выделяется 17 кДж (4,1 ккал) энергии.
При нагревании белков до высоких температур с крепкими кислотами, щелочами, а также под действием ферментов белковые молекулы расщепляются на более . простые соединения. На основании изучения конечных продуктов гидролиза белков было найдено, что в состав молекулы входит до 20 различных аминокислот. Аминокислотами называют соединения, содержащие одновременно аминные и карбоксильные группы. Молекулы большинства природных аминокислот имеют общую структуру, в которой аминогруппа находится в альфа-положении по отношению к карбоксильной:
Следовательно, аминогруппа присоединена к ближайшему от карбоксила углеродному атому. Некоторые аминокислоты имеют аминогруппу в бета- или -гамма-положении.
Глицин Аланин Цистеин
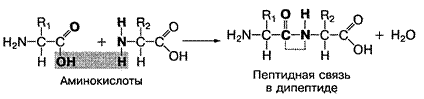
Белки состоят из большого количества (не менее 50) аминокислот, соединенных между собой пептидной связью. Поэтому они называются полипептидами. Пептидная связь — это прочная ковалентная связь между аминогруппой (-NH2) одной аминокислоты и карбоксильной группой (-СООН) — другой аминокислоты. При этом образуется дипептид и высвобождается молекула воды:
Аминокислотная последовательность в белках определяет их пространственную структуру (конформацию). Каждый белок уникален по своей структурной организации, от которой зависят его биологические функции, что будет рассмотрено далее на примере отдельных белков. В образовании пространственной структуры белков участвуют различные типы химических связей. Основными химическими связями в белках являются ковалентные, дисульфидные связи (-S-S-), образующиеся между -SH-группами остатков цистеина, водородные, образующиеся за счет электростатических сил притяжения водорода и кислорода разных функциональных групп в белке, а также ионные связи, образующиеся между ионизированными карбоксильными (-СОО~) и аминными (-NH2) группами аминокислотных радикалов. Выделяют четыре уровня организации структуры белковых молекул: первичную, вторичную, третичную и четвертичную. Первичная структура белка — это определенная последовательность аминокислот в полипептидной цепи, а также их количественный и качественный состав. Последовательность расположения аминокислот в отдельных белках генетически закреплена и обусловливает индивидуальную и видовую специфичность белка. Расшифровка первичной структуры белка имеет большое практическое значение, так как открывает возможность синтеза его в лаборатории. Благодаря расшифровке структуры гормона инсулина и иммуноглобулина эти белки получают синтетически и широко применяют в медицине. Изучение первичной структуры гемоглобина позволило выявить изменения его структуры у людей при отдельных заболеваниях. В настоящее время расшифрована первичная структура более 1000 белков, в том числе ферментов рибонуклеазы, карбоксипептидазы, миоглобина, цитохромов и многих других. Вторичная структура белка — это пространственная укладка полипептидной цепи. Выделяют три типа вторичной структуры: α-спираль, слоисто-складчатая спираль (или ß-спираль) и коллагеновая спираль. При образовании α-спирали полипептидная цепь спирализуется за счет водородных связей таким образом, что витки пептидной цепи периодически повторяются. При этом создается компактная и прочная структура полипептидной цепи белка. Спирализация полипептидной цепи белков открыта американскими учеными Л. Полингом и Р. Кори, α-спираль характерна для белков кератинов, которые являются основой кожи, волос, ногтей.
Слоисто-складчатая структура белка представляет собой линейные полипептидные цепи, расположенные параллельно и прочно связанные водородными связями. Такая структура является основой для фибриллярных белков (миозина, ß-кератина волос и др.). Коллагеновая спираль белка выделяется более сложной укладкой полипептидных цепей. Отдельные цепи спирализованы и закручены одна вокруг другой, образуя суперспираль. Такая структура характерна для коллагена. Коллагеновая спираль имеет высокую упругость и прочность стальной нити. Третичная структура белка — это пространственная укладка спирализованных и линейных участков полипептидной цепи в компактную структуру в виде глобулы (шарообразная или яйцевидная) или фибриллы (нитеобразная). Третичная структура обеспечивает биологическую активность каждого белка. Нарушение этой структуры приводит к частичной или полной потере его биологической функции. Четвертичная структура белка представляет собой объединение нескольких одинаковых или разных полипептидных цепей (субъединиц) со своей третичной структурой в сложную молекулу, проявляющую биологическую активность. Субъединицы соединяются между собой нековалентными связями. Четвертичную структуру имеют многие ферменты (например, лактат-дегидрогеназа, пируватдегидрогеназа), а также гемоглобин. Белки с четвертичной структурой называются олигомерными, или мультимерными. Все четыре уровня организации белковой молекулы взаимосвязаны и обеспечивают нативную (естественную) конформацию каждого белка. В проявлении биологической активности белков особое место занимает третичная и четвертичная структуры, весьма чувствительные к изменению условий среды. Поскольку многие внутриклеточные ферменты имеют четвертичную структуру, то одним из механизмов регуляции их активности является изменение конформации белков.
|
|||||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.62.63 (0.008 с.) |

 Аминокислоты
Аминокислоты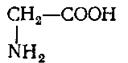
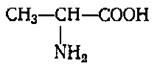
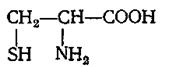
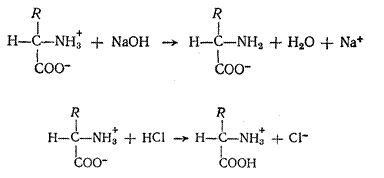
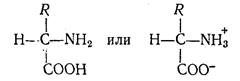 Аминокислоты являются амфотерными электролитами, т. е. обладают свойствами кислот и оснований и могут реагировать как с основаниями, так и кислотами:
Аминокислоты являются амфотерными электролитами, т. е. обладают свойствами кислот и оснований и могут реагировать как с основаниями, так и кислотами: