
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Шоколадный агар с факторами ростаСодержание книги Поиск на нашем сайте
№3 Выращиванием колоний на твердой поверхности получают максимальную плотность клеток, поскольку в данном случае жидкость находится только в промежуточном (межклеточном) пространстве и состав- ляет от 20 до 30 % общего объема (27 % от плотно упакованных тел не- зависимо от их размера). Если инокулят сильно разбавлен, каждая клетка в результате деления дает начало отдельной колонии. Это может быть полезным для массовой культуры, если отбор колонии ведут по какому- то одному признаку (например, если необходимо вырастить вариант, ко- торый образует только «гладкие» колонии). Чаще инокулят бывает не разбавлен, и его равномерно распределяют по всей поверхности среды. В этом случае микроорганизмы растут в виде сплошного газона. Твердую поверхность обычно получают после добавления в среду агара или другого отвердителя. Известен также ряд методов, при которых колонии растут на мембране, помещенной на поверхности жидкой среды в сосуде. Массовая культура бактерий на твердой среде имеет ряд преимуществ по сравнению с культурой, выращиваемой в жидкой среде. 1. В случае культур, выращенных на твердой среде, нет необходимо- сти использовать центрифугу или другие средства для сбора клеток, по- скольку в этих культурах клетки находятся уже в сконцентрированном состоянии. Особенно следует избегать центрифугирования при получе- нии большого количества патогенных или других вредных микроорга- низмов, поскольку при этом образуются аэрозоли. Для сгущения клеток и сбора биомассы на поверхность агаризованной среды пипеткой нано- сят небольшое количество стерильного солевого раствора или буфера и суспендируют в нем выросшие колонии с помощью стерильного стек- лянного шпателя. Таким способом можно получить большое количество клеток с поверхности агаровых сред в чашках Петри, в больших плоских культуральных матрасах и в больших плоских чашках, покрытых крыш- ками из пирекса. №3 2. Твердые культуры свободны от макромолек-ных компонентов и от частиц питательной среды, так как последние обычно нах-ся внутри агарового геля. Более того, твердые культуры отн-но свободны от низком-ых питательных в-в и продуктов метаболизма микр-змов, поскольку для их растворения необходимы знач-но большие объемы среды. След-но, культуры, выращенные на тв. среде, особенно полезны для экспериментов (пригот-ния антигенов или для других целей), когда важна чистота клеточной суспензии. 3. На тв-х средах можно получать рез-ты, к-ые невозможно достичь другим путем. Напр, плодовые тела миксобактерий и эндоспоры опр-ных видов Bacillus обр-ся только при росте культур на тв. среде. Это объяс-ся тем, что лишь в данных усл-х б-рии сохраняют м\ж собой физические связи, а также тем, что в данном случае обеспечивается максимальное снабжение клеток ки- слородом атмосферы и вымывание продуктов метаболизма (например, кислот) из клеточного окружения. Если этого не происходит, рост куль- туры может подавляться.
№3 Вместе с тем выращивание микроорганизмов на твердых средах по сравнению с культивированием в жидкой среде имеет определенные недостатки. 1. Твердая культура имеет ограничения при выращивании больших количеств биомассы. Она дает возможность легко получать граммы кле- ток; десятки граммов выращивать уже затруднительно, а сотни граммов или килограммы клеток на твердой среде в лаборатории вырастить не- возможно. 2. Твердые культуры не обеспечивают однородность популяции кле- ток, т. е. культура гетерогенна в физиологическом отношении. Напри- мер, клетки в верхней части твердой аэробной среды (слой глубиной до 1000 клеток) могут находиться в условиях низкого содержания пита- тельных веществ, но высокого содержания кислорода, в то время как в нижних слоях среды условия могут быть противоположными. Гетеро- генна культура и в техническом смысле, так как клетки микроорганизмов и питательная среда распределены неравномерно. 3. Твердые культуры характеризуются небольшим числом клеток в пересчете на данное количество среды №4,№5 См.№3 №6 Процессы суспензионного или глубинного культивирования Простейшая классификация процессов суспензионного или глубинного культивирования: 1) периодическое культивирование; 2) продленное оптимизированное периодическое культивирование с подпиткой или без нее; 3) многоциклическое культивирование; 4) полунепрерывное культивирование; 5) непрерывно-синхронное культивирование; 6) непрерывное культивирование №7Культивирование б-рий пред-т собой проц. увеличения концентрации некоторых или всех компонентов популяции. Обычно ха- рактеристики этого процесса устанавливаются путем измерений тех или иных его показателей. Периодический метод культивирования предусм-ет внесение посевного материала в питательную среду (инокуляция клетками среды) в начале процесса и получение культуры по достижении заданной фазы развития популяции. Концентрация микроорганизмов в периодической культуре нарастает и останавливается либо из-за лимитирования субстратом, либо из-за ингибирования токсичными продуктами жизнедеятельности. Для этого типа культивирования характерно непрерывное изменение физиологического состояния клеток, вызванное изменениями условий, производимыми жизнедеятельностью самих клеток. Отсюда следует, что периодическая система может поддерживать размножение клеток только в течение ограниченного времени. После фазы экспоненциального (логарифмического) роста популяция начинает испытывать недостаток элементов питания и угнетается продуктами метаболизма, что ведет к нарушению физиологического состояния клеток. Периодические культуры находятся в неустойчивом состоянии, что является серъезным недостатком, особенно когда их применяют при изучении свойств микроорганизмов. Практически все системы периодического культивирования являются закрытыми, поскольку микроорганизмы в них размножаются и проходят все фазы развития без притока питательной среды и оттока культуральной жидкости. 1. Лаг-фаза. При внесении клеток из культуры, находящейся в стационарной фазе, в свежую среду того же состава они приобретают способность к возобновлению роста только после определенного периода, в течение которого происходит изменение их химического состава. Продолжительность периода адаптации может быть различной, но обычно она прямо пропорциональна длительности предшествующей стационарной фазы. В свежей среде длительность лагфазы зависит от количества и возраста посевного материала, а также от изменений состава и концентрации питательных компонентов при внесении инокулята.
№7 Внесение небольшого кол-ва инокулята в большой объем свежей среды может привести к диффузии из клеток витаминов, кофакторов и ионов, которые необходимы для поддержания активности многих внутриклеточных ферментов. Если клетки инокулируют из богатой среды в минимальную, то продолжительность лаг-фазы значительно зависит от объема инокулята, поскольку он содержит микроэлементы, попадающие при инокуляции в ростовую среду. Длит-ть лаг-фазы зависит также и от возраста инокулята. Это связано с тем, что в проц. развития в клетках накапл-ся токсич-е в-тва и недост-но питательных веществ, необходимых для первоначального роста. Часто, при переносе клеток из бедной среды в богатую с увелич-ем возраста инокулята лаг-фаза удлин-ся. Наконец, изменения состава питательных компо- нентов, а также их концентрации при переносе инокулята в свежую среду могут оказывать воздействие на длительность лаг-фазы, влияя на ре- гуляцию активности ферментов и морфологическую дифференцировку клеток. Если клетки переносят с бедной среды в богатую, то питательные компоненты и время расходуются на повышение активности ферментов, необходимых для повышения активности метаболизма в целом. Если же клетки переносят с богатой среды на среду с более низким уровнем пит-х в-в, то они сп-ны немедл., хотя и с низкой скоростью, вступить в экспоненциальную фазу роста. 2. Фаза экспоненциального роста. Экс-ный рост с высо- кими скоростями обычно не поддерживается в микробной популяции длительное время. В норме он огранич-ся вследствие исчерпания доступных источников питания, или накопления токсичных продуктов обмена веществ в ростовой среде, или из-за некоторых изменений в фи- зических свойствах среды. В рез-те этого скорость роста снижается и, в конечном счете, рост прекращается. 3. Стационарная фаза. Изменения в физическом и химическом составе среды приводят к переходу культуры в стационарную фазу, в которой увеличения количества клеток не происходит, но клетки еще нуждаются в источниках энергии для поддержания своей жизнедеятельности. Переход из экспоненциальной фазы в стационарную включает период несбалансированного роста, когда разные клеточные компоненты синтез-ся с разными скоростями. Поэтому в стационарной фазе химический состав клеток отличается от их состава в экспоненциальной фазе. Клетки меньше по размеру и менее чувствительны к физическим и хи- мическим воздействиям. В стационарной фазе количество биомассы ос- тается постоянным. №7 4. Фаза отмирания. К гибели клеток приводит ряд факторов, важнейшим из которых является исчерпание запасов энергии в клетке. Наблюдается резкое экспоненциальное уменьшение числа жизнеспособных клеток. Скорость отмирания зависит от видовых особенностей организма. Для некоторых целей вполне достаточно качественной характеристики роста, т. е. простого наблюдения, имеет ли место вообще рост культуры. Но для того чтобы иметь дальнейшую более полную информацию, необходимо измерять рост количественно. Если рост периодической культуры прослеживается по увеличению бактериальной массы, то для получения точной информативной картины роста культуры клеток анализируются разные количественные параметры роста: скорость роста, экономический коэффициент, выход бактериальной биомассы, время генерации и другие. При определении параметров роста исследуют рост простой гомогенной периодической культуры. Предполагается, что такая система состоит из хорошо перемешиваемой, засеянной питательной среды. №8 Продленный периодический процесс культивирования, как и периодический, предусматривает одноразовую загрузку и разгрузку ферментера. Однако цикл развития микроорганизмов в продленном периодическом процессе удлиняется либо за счет подпитки (периодической или непрерывной), либо за счет длительного удержания клеток в системе (диализная культура). Известно, что зависимость концентрации микроорг-змов и удельной скорости роста от времени в продленном периодическом процессе более растянута во времени по сравнению с таковыми в периодическом процессе. При этом продлевается как экспоненциальная фаза, так и в особенности фаза линейного роста. Культура с добавлением источников питания – это один из методов получения роста, лимитированного субстратом. При этом экономический коэффициент в культуре с подпиткой выше по сравнению с простой пе- риодической культурой. Подпитка переводит периодический процесс в продленный периодический и используется в основном для получения продуктов биосинтеза, что существенно увеличивает производительность процесса. №9 В периодической культуре, как известно, постепенно накапливаются продукты метаболизма, которые приостанавливают рост. Для увеличения выхода продуктов или с целью повышения концентрации биомассы применяют процесс диализа. Суть этого метода заключается в том, что культура развивается в пространстве, ограниченном полупроницаемой мембраной, а продукты диффундируют во внешний раствор. Наиболее простым диализным методом является культивирование в целлофановых мешках, погруженных в питательную среду. Метод был разработан рядом авторов для получения экзотоксинов и позволил получать высокоактивные препараты, но не нашел широкого практического применения из- за сложности осуществления его в производственных масштабах и не- возможности получения токсина в больших количествах. К продленным периодическим процессам можно отнести культивирование микроорганизмов в диализной системе с протоком среды, поскольку проток удлиняет период роста и развития микробной популяции, но систе- ма не является непрерывной из-за отсутствия оттока биомассы. В диализ- ной системе с протоком среды общая биомасса увеличивается до тех пор, пока плотность культуры не станет такой, что дальнейшее перемешивание биомассы будет невозможным. Таким образом, метод дает возможность выращивать культуру до достижения высокой плотности биомассы. Диализные культуры применяют в основном в трех случаях: 1) для концентрирования недиффундирующего продукта; 2) для уменьшения концентрации диффундирующего продукта, ингибирующего рост, и по- вышения выхода биомассы; 3) для накопления и отделения от клеток диффундирующего продукта.
№11 В полунепрерывных системах полная загрузка и разгрузка ферментера осуществляются однократно, однако в процессе роста культуры часть ее сливается, а освободившийся объем заливается свежей питательной средой. Таким образом, функционирует сливно-доливная система. Следовательно, полунепрерывное культивирование характеризуется частотой и объемом сливаемой выросшей культуры и добавлением свежей питательной среды в рабочую емкость ферментера. Установившиеся режимы полунепрерывного культивирования характеризуются колебанием концентрации микроорганизмов около одной и той же постоянной величины и постоянством средней удельной скорости роста популяции. Полунепрерывное культивирование микроорганизмов осуществляется в открытой динамической гомогенной одностадийной системе в любом ферментере для периодического культивирования, оснащенном сис- темой перемешивания и аэрации. Различные варианты полунепрерывных систем используются в производстве дрожжей, водорослей, антибиотиков, лимонной кислоты и др. №10 Для культивирования с диализом используются мембраны, отличающиеся размером пор. Диализные мембраны задерживают клетки и макромолекулы, но проницаемы для таких мелких молекул, как основные питательные компоненты, требующиеся микроорганизмам для их роста. Диализные мембраны изготавливают из пергамента, целлофана, ацетатцеллюлозы, полиамида, поликарбо-ната, кремний и др. Для микробиологических целей при изготовлении мембран используют материалы, обеспечивающие автоклавируемость мембран, размер их пор, высокий уровень отсечки, химическая инертность и проницаемость (которая в свою очередь определяется пористостью, емкостью и толщиной мембраны), а также наибольший экономический коэффициент. Типы диализаторов:Диализатор объемного типа:Конструкция диализатора такого типа проста и пред. собой «мешок» из диализной мембраны, погруженный в диффузат. Дост-ство такой констр-ции явл-ся простота и дешевизна. Но есть недостатки: - малая удельная поверхность и довольно большая толщина мембран для обеспечения их механической прочности. - проц. диализа прот-т медл., т.к. и диализат, и разделяемый р-р неподвижны и мембраны имеют большую толщину. Ап-ат вкл. мембрану в виде трубки, свернутой в спираль (змеевик), погруж-ную в емкость с диализатом.За счет конструк-ных особ-ей ув-ся площадь мембраны, а за счет прокачив-я разделяемого рас-ра внутри змеевика, интенсифицируется массообмен №12 В непрерывных процессах пит. среда подается непрерывно, удаление биомассы и продуктов ее жизнедеятельности также осуществляется непрерывно. Установившиеся режимы непрерывного культивирования характери- зуются постоянством концентрации микроорганизмов и удельной скорости роста популяции. Непрерывное культивирование проводится в открытой динамической системе, которая может быть как гомогенной, так и гетерогенной. способна к длительной работе Любой периодический процесс можно перевести в непрерывнопроточный. ,что открывает возможности для поддержания постоянных условий роста путем создания тако- го состава питательной среды, чтобы только один желаемый фактор лимитировал рост. Если в таком процессе плотность популяции определяется химическим составом среды (концентрацией лимитирующего рост фактора), его называют хемостатным культивированием. Изменяя концентрацию лимитирующего рост фактора, можно изменять плотность популяции. Изменяя скорость разбавления, можно получать режимы, обеспечивающие различную скорость роста популяции. При медленном протоке среды, т. е. при медленном росте, культура испытывает сильную лимитацию, глубокое голодание по данному субстрату. При быстром протоке среды, т. е. при быстром росте, степень голодания слабая, приближающаяся к условиям экспоненциального роста. Хемостатный способ культивирования в строго контролируемых условиях является основным для изучения физиологии, биохимии и вообще всех свойств микробных клеток и культур . Хемостат имеет аналоги в природе. Аналогия заключается в том, что подобные устройства – это открытые непрерывные системы, через которые постоянно идут потоки энергии и веществ. Поэтому при непрерывном культивировании в лаборатории можно моделировать природные условия (например, в водоеме, в пищеварительном тракте), что поможет изучению вопросов экологии. При этом за короткое время можно наблюдать явления, происходящие в природе длительное время, и выявить экологические закономерности. №13 широко известный принцип управления процессом – турбидостат . В нем подача питательной среды осуществляется по команде фотоэлектрического элемента, регистрирующего оптическую плотность культуры. Скорость разбавления сама устанавливается в соот- ветствии с заданной плотностью популяции. Этим турбидостат отличается от хемостата, в котором фиксируется скорость разбавления, соот-но которой устанавл-ся конц-ция биомассы. Хотя теоретически взаимосвязь между концентрацией биомассы и скоростью разбавления подчиняется одним и тем же закономерностям в хемостате и турбидостате, методы управления процессами различны. Турбидостат позвол. получать скорости роста, равные макс-ой скорости, которые примен-ся при изучении культур, фиксированных в стадии экс- поненциального роста. Турбидостат может использоваться для получения мутантов, более устойчивых к ингибирующим рост фак-м. №13 Непрерывно-проточное культивир-ние может осущ-ся в одном ферментере (одностадийный процесс) или в двух и более фермен- терах (многостадийный процесс). Для получения высоких концентраций биомассы могут быть использованы одностадийные системы с возвратом клеток, в которых клетки, отделенные от культуральной жидкости с помощью насоса, возвращаются обратно в ферментер. Возврат клеток (рециркуляция) имеет значение в тех процессах, в которых за время пребывания в ферментере клетки не успевают реализовать свои потенциальные возможности в отношении синтеза целевого продукта. Применение многостадийных систем позволяет получать культуру при любой скорости роста – от лаг-фазы до экспоненциальной и стационарной. Многостад-е с-мы обычно исп-ся для получения вторичных продуктов микробного синтеза, накопление которых в той или иной степени отстает от кинетики роста биомассы. Многост-ное культивирование с успехом применяется при получении молочной кислоты, этилового спирта и т. д. «Батарея» ферментеров применяется также для переработки высоких концентраций субстрата при получении продуктов как первой, так и второй фазы роста. №14 Непрерывно-проточное культивирование откр. возм-ти для поддержания постоянных условий роста путем создания такого состава питательной среды, чтобы только один желаемый фактор лимитировал рост. Если в таком процессе плотность популяции определяется химическим составом среды (концентрацией лимитирующего рост фактора), его называют хемостатным культивированием. Изменяя концентрацию лимитирующего рост фактора, можно изменять плотность популяции, т.е. изменяя скорость разбавления, можно получать режимы, обеспечивающие различную скорость роста популяции. При таком методе, регулируя скорость протока, можно воспроизвести любую точку роста периодической культуры. В системе идеального смешения микроорганизмы растут в биореакторе при интенсивном перемешивании в культуральной среде, постоянной по своему составу, и, следовательно, в каждый данный момент времени находятся в одном и том же физиологическом состоянии, т.е. в состоянии установившегося динамического равновесия, которое называют«steadystate». В установившемся режиме скорость протока среды, отнесенная к единице объема культуры в ферментере, называется коэффициентом разбавления (D) и равняется удельной скорости роста. При этом культура находится в устойчивом стационарном состоянии динамического равновесия и обладает способностью самопроизвольно автоматически подстраиваться к изменениям условий. При таком способе культивирования нельзя получить устойчивого состояния только при максимальной скорости роста. В хемостате практически можно только приблизиться к максимальной удельной скорости роста, но не достичь ее, потому что такая скорость роста соответствует критической скорости разбавления, при которой биомасса вымывается из ферментера, что является одним из существенных недостатков хемостата.
№14 Для борьбы с данным явлением возможно использовать комплекс «ферментер-сепаратор». В этом комплексе выходящая из ферментера жидкость сгущается на сепараторе, и часть сгущенного потока непрерывно возвращается в ферментер, остальная часть идет как товарный продукт. Осветленная жидкость сбрасывается в стоки. Основными направлениями использования реципкуляции являются: повышение производительности системы непрерывного культивирования и более полное потребление субстрата из среды. Одностадийный хемостат применяется при необходимости воспроизвести на протоке любую скорость роста клеток, кроме максимальной. Двухстадийный хемостат позволяет создавать культуры при скорости роста, близкой к максимальной, и определять условия ее повышения. Для этого в первом ферментере ведется культивирование при скорости разбавления, меньшей чем удельная скорость роста, а во второй подается культура из первого. Особенности двухстадийного хемостата: 1. Вымывания культуры во втором ферментере не происходит из-за непрерывного поступления культуры из первого. Следовательно, концентрация биомассы никогда не сможет стать равной нулю при любой скорости разбавления. Будет возрастать удельная скорость роста клеток и экономический коэффициент. 2. Концентрация субстрата во втором аппарате всегда меньше, чем в первом. Субстрат расходуется из запаса входящего потока. Это имеет значение в тех случаях, когда важен не только выход биомассы, но и ее чистота. 3. Концентрация биомассы во втором аппарате всегда выше, чем в первом (учитывается прирост биомассы). 4. Двухстадийный хемостат часто оказывается удобней для тех процессов, в которых целевым продуктом является не биомасса, а метаболиты. №15 Другой известный принцип управления процессом – турбидостат. В нем подача питательной среды осуществляется по команде фотоэлектрического элемента, регистрирующего оптическую плотность культуры. Скорость разбавления сама устанавливается в соответствии с заданной плотностью популяции. Турбидостат позволяет получать максимальные скорости роста, которые применяются при культивировании клеточных культур, фиксированных в стадии экспоненциального роста. В настоящее время разработаны различные варианты непрерывного культивирования микроорганизмов, работающие по принципу турбидостата – pH-стат, оксистат, СО2-стат, теплостат, респиростат, вискозистат и т. д., названия которых соответствуют задаваемому параметру. Любой параметр, который изменяется в периодической культуре и на который существует датчик, может быть использован для управления ростом по типу турбидостата. Управляющими параметрами могут быть комплексные параметры, например, содержание кислорода и углекислоты в отходящем воздухе, характеризующие дыхательный коэффициент. Респиростат Способ управления основан на использовании в качестве датчиков газоанализаторов кислорода или углекислого газа, измеряющих интенствность дыхания культуры. Эта величина пропорциональна росту, образованию продукта и поддержанию жизнедеятельности клеток, т.е. пропорциональна концентрации биомассы. Поэтому, регулируя интенсивность дыхания можно регулировать и концентрацию биомассы, а следовательно, скорость подачи субстрата (D). В респиростате задается определенная величина интенсивности дыхания, близкая к максимальной. В зависимости от этого при снижении интенсивности дыхания величину скорости разбавления повышают, и наоборот. Еще лучше не поддерживать дыхание на постоянном уровне, а все время искать скорость разбавления, обеспечивающую его максимум. Этот алгоритм управления легко реализуется с помощью современных систем управления процессами культивирования.
№16 Стремление получить культуры, все клетки которых в данный момент нах-ся в одной фазе развития, привело к разработке м-да синхронизации деления микр-змов. Что позволяет раздельно и поэтапно изучать физиологические и биохим-ие проц., протекающие на разных стадиях развития клетки.( грибы, бактерии, простейшие, водоросли, а также клетки культуры ткани и т. п. Среди бактерий синхронное размножение изучалось главным образом на популяциях Escherichia coli, Salmonella typhimurium, Corynebacterium diphtheriae и др.) Периодическое синхронное культивирование. обычно применяют популяции в фазе экспоненциального роста, когда клетки наиболее однородны по продолжительности периода гене- рации. Степень участия клеток популяции в синхронном делении называют степенью синхронизации. Она выражается значениями индекса синхрони- зации, который характеризует степень однородности популяции и позволяет сравнить эффективность различных синхронизирующих воздействий. «индекс синхронизации» Шербаума (Is), вычисляемый по формуле: Is = (N1/N0 – 1) · (1 – T/g), где N0 – число клеток непосредственно перед взрывом синхронного де- ления; N1 – число клеток после синхронного деления; Т – время, в течение которого происходит синхронное деление; g – продолжительность одной генерации. Способы, вызывающие синхронное деление, весьма разнообразны и многочисленны. В зависимости от характера воздействия их можно разделить на 3 большие группы: 1) механический отбор (селективные методы); 2) действие физических факторов и 3) химико-биологические воз- действия. 1) Методы, основанные на механическом отборе однородных по некоторым признакам клеток из асинхронно делящейся популяции, называются естественными, или селективными. Некоторые из них получили наиболее широкое распространение в микробиологических исследованиях, например фракционное фильтрование и дифференциальное центрифугирование. Таким образом, первая группа методов синхронизации заключается в механическом отборе клеток из популяции в зависимости от их объема, массы или определенной формы существования, как это имеет место в случае отбора спор. Применение селективных методов основано на предположении, что такие свойства, как объем и масса клеток, отражают в известной мере определенное физиологическое состояние. Эти методы имеют то преимущество, что не создают никакого препятствия в обмене веществ у отдельных клеток, как это бывает при использовании других методов. №17 Непрерывно-синхронное культивирование. Общим и весьма существенным недостатком периодических синхронных культур является быстрая потеря синхронности, наступающая через 2–3 генерации. Причина подобного явления может заключаться в том, что не все клетки популяции делятся, достигнув одного и того же размера, возраста или момента времени, прошедшего после предыдущего деления. Принято считать, что решающая роль принадлежит фазе развития исходной синхронизируемой культуры. Десинхронизация наступает быстрее при воздействии на культуру синхронизирующим агентом в фазе замедления скорости размножения, т. е. более гетерогенную в отношении продолжительности генерации отдельных клеток. С середины 60-х гг. XX в. началась разработка методов получения синхронизированных культур на протоке. Такой способ известен как непрерывно-синхронный, или фазовый, метод культивирования, гаранти- рующий поддержание синхронного деления клеток неограниченно долгое время. Метод основан на периодическом сливе из ферментера половины объема выросшей культуры через промежутки времени, равные одной генерации, и одновременном добавлении такого же количества свежей питательной среды, что обеспечивает импульсную подачу источников питания. Состав среды подбирается таким образом, чтобы при удвоении биомассы происходило исчерпание питательных веществ, вследствие чего рост культуры должен быть приостановлен. Добавление свежей среды приводит к восстановлению роста, т. е. синхронизация деления достигается голоданием клеток по какому-либо лимитирующему рост субстрату. Лимитирующими факторами могут служить источники азота, углерода, минеральных солей и т. д. Имеются также данные, свидетельствующие о том, что синхронное деление клеток может быть индуцировано изменением рН, температуры и других условий культивирования, оказывающих воздействие на ряд метаболических процессов клеток.
№19 Под ростом понимают согласованное увеличение количества всех химических компонентов, формирующих клеточные структуры. Рост клеток обычно сопровождается увеличением их массы и размеров. Однако эта закономерность наблюдается не всегда, так как в некоторых условиях клетки способны просто накапливать запасные или резервные вещества, т. е. масса может увеличиваться, но роста при этом не наблюдается. В подходящей же среде, к которой бактерии полностью адаптированы, они находятся в состоянии сбалансированного роста. В период сбалансированного роста удвоение биомассы сопровождается удвоением всех других учитываемых параметров популяции, например количества белка, ДНК, РНК и внутриклеточной воды. Культуры, растущие сбалансированно, сохраняют постоянный химический состав. В условиях сбалансированного роста легко определить величину скорости роста бактериальной популяции в каждый момент времени, если измерить прирост любого компонента клетки по отношению к его исходному количеству. Таким образом, в культуре, растущей сбалансированно, скорость прироста вещества клеток в любой данный момент пропорциональна числу или массе имеющихся в это время бактерий. Коэффициент пропорциональности называют удельной скоростью роста (^). Данная величина отличается для разных культур, и даже для одной культуры в зависимости от условий выращивания она меняется. Если рост клеток в культуре ограничен количеством внесенного в питательную среду компонента, то между его начальной концентрацией и полученной биомассой клеток существует постоянная линейная зависимость (при условии ограничения роста только по одному параметру). Масса клеток, образованная на единицу использованного компонента среды, представляет собой величину, которую называют экономическим коэффициентом (или выходом биомассы) В лабораторных и промышленных условиях используют два основных способа культивирования микроорганизмов: периодическое (статическое) и непрерывное (проточное). Рост бактерий в периодической культуре происходит до тех пор, пока содержание какого-нибудь из необходимых им компонентов питательной среды не достигнет минимума, после чего рост прекращается. Если на протяжении этого времени не добавлять питательных веществ и не удалять конечных продуктов метаболизма, то получается так называемая периодическая культура (популяция клеток в ограниченном жизненном пространстве). №20 Для заполнения анаэростатов газовой смесью используют газометры . Газометр заполняется отдельным газом или газовой смесью через кран . Жидкость, первоначально заполняющая газометр, через кран вытесняется в сосудА . Затем кран закрывают, осторожно открывают кран второй, и жидкость из сосуда Б поступает в газометр и вытесняет газ в анаэростат (В). Объем газа, заполняющего анаэростат, измеряют по объему жидкости, поступившей из сосуда Бв газометр. Необходимо помнить, что выпускаемые промышленностью газы даже высокой чистоты содержат, как правило, небольшие количества кислорода. Поэтому, чтобы очистить газы от остатков кислорода, их пропускают через химические поглотители, например, через колонки с раскаленной восстановленной металлической медью. Для удаления кислорода из окружающей среды при культивировании анаэробов иногда используют вещества, поглощающие кислород. Эти вещества можно поместить на дно большой пробирки, имеющей специальную подставку, на которую ставят пробирку с бактериальной культурой . Удобно использовать специальные сосуды, во внешнюю расширенную часть которых вносят поглощающую смесь, а во внутреннюю - питательную среду с микроорганизмами. Культуральный сосуд закрывают ватной пробкой, а сосуд с поглотителем - резиновой, что обеспечивает герметичность системы (рис. 48). Применяют также вакуумные или обычные эксикаторы, в которые на дно или в специальные сосуды помещают поглощающие кислород вещества. В качестве поглотителя в лабораторной практике используют щелочной раствор пирогаллола, дитионита натрия (Na Напр., на каждые 100 мл емкости используют 1 г пирогаллола и 10 мл 2,5 н. раствора гидроксида натрия. Т.к.многие анаэробы нуждаются в углекислоте для биосинтеза веществ клетки, пирогаллол растворяют не в щелочи, а в насыщенном растворе бикарбоната натрия. Полноту поглощения кислорода химическими веществами контролируют, используя раствор, сод-щий окислительно-восстановительный индикатор. Для приготовления раствора смешивают равные объемы 0,024%-ного раствора NaOH, 0,015%-ного водного раствора метиленового синего и 6%-ного раствора глюкозы;в качестве антисептика к раствору добавляют тимол. Перед употребл-ем в пробирку наливают 5 мл смеси и нагревают в кипящей водяной бане до обесцвечивания, быстро охлаждают и помещают в анаэростат. В анаэробных условиях раствор остается бесцветным.Удобен в обращении анаэростат системы Газ Пак (Gas Pak).
№21 Для выделения стафилококков в среду может быть добавлен хлористый натрий в концентрации 7,5 %. К элективным относят среды, содержащие антибиотики, соли, измененный pH, соли желчных кислот и др.; 4) дифференциально-диагностические – служат для идентификации определенных микроорганизмов на основании исследования их физиолого-биохимических особенностей. Шоколадный агар с добавлением смеси ростовых факторов предназначен для выделения и культивирования прихотливых микроорганизмов, принадлежащих к родам Neisseria, Haemophilus иStreptococcus (S. pneumoniae).
|
||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.174.145 (0.018 с.) |

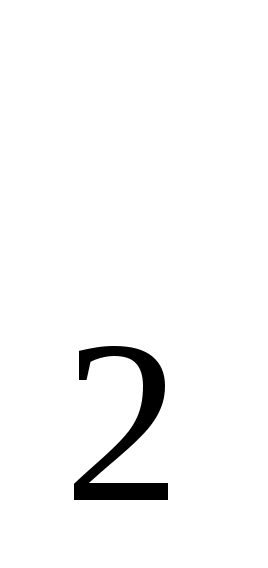 S
S 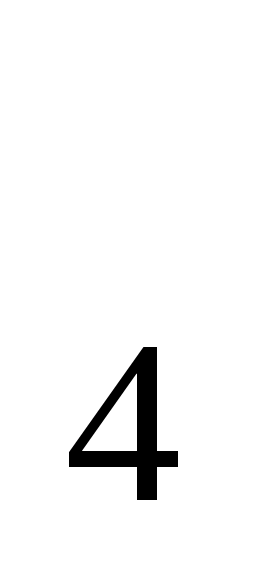 ), металлическое железо и некоторые другие реактивы. Но необходимо учитывать поглощающую способность реактивов и объем замкнутого простр-ва, в кот-м выращивается культура.
), металлическое железо и некоторые другие реактивы. Но необходимо учитывать поглощающую способность реактивов и объем замкнутого простр-ва, в кот-м выращивается культура.


