
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обратите внимание: в ответе следует записать молекулярное, полное и сокращённое ионное уравнения только одной реакции ионного обмена.Содержание книги
Поиск на нашем сайте
Пример 2. Для выполнения задания используйте следующий перечень веществ: перманганат калия, карбонат натрия, нитрит натрия, фосфат бария, серная кислота. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Среди перечисленных веществ возможна реакция ионного обмена между карбонатом натрия и серной кислотой, которая протекает с выделением углекислого газа. Составим молекулярное, полное ионное и сокращенное ионное уравнения этой реакции. Молекулярное уравнение реакции: Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O Полное ионное уравнение реакции: 2Na+ + CO Сокращенное ионное уравнение реакции: 2H+ + CO Пример 3. Для выполнения задания используйте следующий перечень веществ: сульфид меди (II), нитрат серебра, азотная кислота, хлороводородная кислота, фосфат калия. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Как уже отмечалось, сульфид меди (II) CuS не будет вступать в реакцию ионного обмена с хлороводородной кислотой HCl, а при его взаимодействии с азотной кислотой HNO3 будет происходить не обменная, а окислительно-восстановительная реакция. Таким образом, из предложенного перечня веществ реакция ионного обмена возможна между нитратом серебра AgNO3 и хлороводородной кислотой HCl, которая будет протекать с выпадением осадка хлорида серебра AgCl. Составим молекулярное, полное ионное и сокращенное ионное уравнения этой реакции. Молекулярное уравнение реакции: AgNO3 + HCl = AgCl↓+ HNO3 Полное ионное уравнение реакции: Ag+ + NO Сокращенное ионное уравнение реакции: Ag+ + Cl− = AgCl↓ Теперь, вспомнив основные понятия и ознакомившись с примерами заданий, можно приступить к самостоятельному выполнению заданий.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Для выполнения задания 1 используйте следующий перечень веществ: перманганат калия, хлорид калия, сульфат натрия, нитрат цинка, гидроксид калия. Допустимо использование водных растворов веществ.
1.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 2 используйте следующий перечень веществ: оксид марганца (IV), нитрат меди (II), хлороводородная кислота, гидроксид цинка, сульфат бария. Допустимо использование водных растворов веществ. 2.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 3 используйте следующий перечень веществ: сера, бромид натрия, гидроксид калия, сульфат железа (II), оксид магния. Допустимо использование водных растворов веществ. 3.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 4 используйте следующий перечень веществ: хлорид магния, пероксид водорода, гидроксид железа (II), нитрат цинка, серная кислота. Допустимо использование водных растворов веществ. 4.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 5 используйте следующий перечень веществ: хлорид хрома (III), бром, гидроксид натрия, нитрат лития, гидрокарбонат калия. Допустимо использование водных растворов веществ. 5.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 6 используйте следующий перечень веществ: гидроксид магния, хлорид железа (III), серная кислота, сульфид натрия, нитрат цинка. Допустимо использование водных растворов веществ. 6.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 7 используйте следующий перечень веществ: гидрокарбонат кальция, железная окалина, азотная кислота, соляная кислота, углекислый газ, оксид кремния (IV). Допустимо использование водных растворов веществ. 7.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 8 используйте следующий перечень веществ: сероводород, углерод, хлорид калия, гидроксид натрия, сульфат железа (III). Допустимо использование водных растворов веществ. 8.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 9 используйте следующий перечень веществ: перманганат калия, хлорид бария, оксид серы (IV), оксид натрия, сульфат алюминия. Допустимо использование водных растворов веществ. 9.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 10 используйте следующий перечень веществ: гидроксид калия, оксид магния, хлорид алюминия, оксид азота (IV), нитрат бария. Допустимо использование водных растворов веществ. 10.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 11 используйте следующий перечень веществ: фосфор, нитрат серебра, гидроксид бария, бромид магния, фторид кальция. Допустимо использование водных растворов веществ. 11.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания 12 используйте следующий перечень веществ: кремний, фосфат серебра, гидроксид натрия, нитрат аммония, бромид калия. Допустимо использование водных растворов веществ. 12.Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
ВАРИАНТЫ ОТВЕТОВ 1. Zn(NO3)2 + 2KOH = Zn(OH)2↓ + 2KNO3 Zn2+ + 2NO Zn2+ + 2OH− = Zn(OH)2↓ 2. Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Zn(OH)2 + 2H+ + 2Cl− = Zn2+ + 2Cl− + 2H2O Zn(OH)2 + 2H+ = Zn2+ + 2H2O
3. FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4 Fe2+ + SO Fe2+ + 2OH− = Fe(OH)2↓
4. Fe(OH)2 + H2SO4 = FeSO4 + 2H2O Fe(OH)2 + 2H+ + SO Fe(OH)2 + 2H+ = Fe2+ + 2H2O
5. 2KHCO3 + 2NaOH = K2CO3 + Na2CO3 + 2H2O 2K+ + 2HCO HCO
6. Na2S + H2SO4(разб) = Na2SO4 + H2S↑ 2Na+ + S2− + 2H+ + SO 2H+ + S2− = H2S↑
7. Ca(HCO3)2 + 2HCl = CaCl2 + 2CO2↑ + 2H2O Ca2+ + 2HCO H+ + HCO
8. H2S + 2NaOH = Na2S + 2H2O H2S + 2Na+ + 2OH− = 2Na+ + S2− + 2H2O H2S + 2OH− = S2− + 2H2O
9. 3BaCl2 + Al2(SO4)3 = 3BaSO4↓ + 2AlCl3 3Ba2+ + 6Cl− + 2Al3+ + 3SO Ba2+ + SO
10. AlCl3 + 3KOH = Al(OH)3↓ + 3KCl Al3+ + 3Cl − + 3K+ + 3OH− = Al(OH)3↓ + 3K+ + 3Cl− Al3+ + 3OH− = Al(OH)3↓
11. 2AgNO3 + MgBr2 = 2AgBr↓ + Mg(NO3)2 2Ag+ + 2 NO Ag+ + Br− = AgBr↓
12. NH4NO3 + NaOH = NH3↑ + H2O + NaNO3
NH NH Литература 1. Глинка, Н.Л. Общая химия: учебное пособие для вузов. – М.: Интеграл-Пресс, 2009. 2. Дзудцова, Д.Д. Окислительно-восстановительные реакции / Д.Д. Дзудцова, Л.Б. Бестаева. − М.: Дрофа, 2008. 3. Еремин, В.В. Химия. Углубленный уровень. 10 класс: учебник / В.В. Еремин, Н.Е. Кузьменко, А.А. Дроздов, В.В. Лунин. – М.: Дрофа, 2016. 4. Еремин, В.В. Химия. Углубленный уровень. 11 класс: учебник / В.В. Еремин, Н.Е. Кузьменко, В.И. Теренин, А.А. Дроздов, В.В. Лунин. – М.: Дрофа, 2016. 5. Кузьменко, Н.Е. Начала химии / Н.Е. Кузьмено, В.В. Еремин, В.А. Попков. – М.: Экзамен, 2000. 6. Общая химия: учеб. для студ. учреждений высш. проф. образования / Г.П. Жмурко, Е.Ф. Казакова, В.Н. Кузнецов, А.В. Яценко; под ред. С.Ф. Дунаева. – М.: Издательский центр «Академия», 2012. 7. Пузаков, С.А. Пособие по химии для поступающих в вузы / С.А. Пузаков, В.А. Попков. М.: Высшая школа, 2001.
|
|||||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 7; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.34.148 (0.007 с.) |

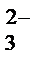 + 2H+ + SO
+ 2H+ + SO 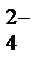 = 2Na+ + SO
= 2Na+ + SO 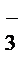 + H+ + Cl− = AgCl↓ + H+ + NO
+ H+ + Cl− = AgCl↓ + H+ + NO 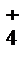 + NO
+ NO 


