
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Задания с единым контекстом по темеСодержание книги
Поиск на нашем сайте
Задания с единым контекстом по теме «Реакции ионного обмена»
Л.И. Асанова, к.п.н., доцент кафедры естественнонаучного образования ГБОУ ДПО «Нижегородский институт развития образования»
Важной и значимой является тема «Реакции ионного обмена». Какой теоретический материал необходимо знать и уметь применять для того, чтобы успешно справиться с этим заданием? Протекание реакций обмена между кислотами, основаниями и солями в водном растворе возможно в тех случаях, когда в результате реакции образуется осадок, газ или слабый электролит, например, вода. Уравнение реакции ионного обмена можно записать в трех формах: молекулярной, полной ионной и сокращенной ионной. Суть реакции ионного обмена отражает ионное уравнение. При составлении уравнений реакций ионного обмена следует учитывать, что в виде ионов записывают формулы сильных электролитов: · сильных кислот (HCl, HBr, HI, HNO3, H2SO4, HClO4 и др.); · щелочей (NaOH, KOH, Ca(OH)2, Ba(OH)2 и др.); · растворимых средних солей (см. таблицу растворимости). В недиссоциированной на ионы форме записывают формулы: · нерастворимых в воде кислот, оснований, солей (см. таблицу растворимости); · слабых электролитов (H2O, NH3∙H2O, CH3COOH и др.). Отметим, что реакции ионного обмена протекают в направлении связывания ионов и не сопровождаются изменением степеней окисления атомов. Покажем на конкретных примерах, как следует записывать уравнения реакций ионного обмена в случае образования осадка, выделения газа и образования слабого электролита. 1. Образование осадка: взаимодействие растворов фторида натрия NaF и нитрата кальция Ca(NO3)2. Молекулярное уравнение реакции: 2NaF + Ca(NO3)2 = CaF2↓ + 2NaNO3 Полное ионное уравнение реакции: 2Na+ + 2F− + Ca2+ + 2NO Сокращенное ионное уравнение реакции: Ca2+ + 2F− = CaF2↓ 2. Выделение газа: взаимодействие раствора карбоната калия K2CO3 с соляной кислотой HCl. Молекулярное уравнение реакции: K2CO3 + 2HCl = 2KCl + CO2↑ + H2O Полное ионное уравнение реакции: 2K+ + CO Сокращенное ионное уравнение реакции: 2H+ + CO 3. Образование слабого электролита: взаимодействие гидроксида натрия NaOH и азотной кислоты HNO3. Молекулярное уравнение реакции: NaOH + HNO3 = NaNO3 + H2O Полное ионное уравнение реакции: Na+ + OH− + H+ + NO Сокращенное ионное уравнение реакции: H+ + OH− = H2O Реакции ионного обмена протекают в направлении наиболее полного связывания ионов. Например, реакция между нерастворимым в воде сульфидом железа(II) FeS и соляной кислотой HCl возможна потому, что в образующемся в результате этой реакции сероводороде сульфид-ион связан более прочно, чем в сульфиде железа (II). Молекулярное уравнение реакции: FeS + 2HCl = FeCl2 + H2S↑ Полное ионное уравнение реакции: FeS + 2H+ + 2Cl− = Fe2+ + 2Cl− + H2S↑ Сокращенное ионное уравнение реакции: FeS + 2H+ = Fe2+ + H2S↑ Обратите внимание на то, что не все сульфиды металлов способны растворяться в соляной кислоте. Так, сульфид меди(II) CuS, в отличие от сульфида железа (II) FeS, в эту реакцию не вступает, так как, сульфид-ион в сульфиде меди(II) CuS связан более прочно, чем в сероводороде H2S: CuS + HCl Однако обратная реакция – выпадение осадка сульфида меди (II) CuS при пропускании сероводорода H2S через раствор соли меди (II) – будет возможна: Молекулярное уравнение реакции: CuCl2 + H2S = CuS↓ + 2HCl Полное ионное уравнение реакции: Cu2+ + 2Cl− + H2S = CuS↓ + 2H+ + 2Cl− Сокращенное ионное уравнение реакции: Cu2+ + H2S = CuS↓ + 2H+ А теперь попробуем применить описанные закономерности для выполнения задания 31. При выполнении этих заданий нам пригодится таблица растворимости кислот, оснований и солей в воде. Пример 1. Для выполнения задания используйте следующий перечень веществ: сульфат хрома (III), нитрат бария, гидроксид калия, пероксид водорода, хлорид серебра. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции. Протекание реакций ионного обмена среди перечисленных веществ вследствие образования осадка возможно в двух случаях: 1) при взаимодействии сульфата хрома (III) Cr2(SO4)3 с нитратом бария Ba(NO3)2 с образованием осадка сульфата бария BaSO4; 2) при взаимодействии сульфата хрома (III) Cr2(SO4)3 с гидроксидом калия KOH с образованием осадка гидроксида хрома (III) Cr(OH)3. Кроме того, связывание ионов возможно также при взаимодействии сульфата хрома (III) Cr2(SO4)3 с избытком гидроксида калия KOH с образованием растворимой комплексной соли – тетрагидроксохромита калия K[Cr(OH)4] (реакция 3). Составим молекулярные, полные ионные и сокращенные ионные уравнения этих трех реакций. 1) Взаимодействие сульфата хрома (III) Cr2(SO4)3 с нитратом бария Ba(NO3)2: Молекулярное уравнение реакции: Cr2(SO4)3 + 3Ba(NO3)2 = 3BaSO4↓ + 2Cr(NO3)3 Полное ионное уравнение реакции: 2Cr3+ + 3SO Сокращенное ионное уравнение реакции: Ba2+ + SO 2) Взаимодействие сульфата хрома (III) Cr2(SO4)3 с гидроксидом калия KOH с образованием осадка гидроксида хрома (III) Cr(OH)3. Молекулярное уравнение реакции: Cr2(SO4)3 + 6KOH = 2Cr(OH)3↓+ 3K2SO4 Полное ионное уравнение реакции: 2Cr3+ + 3SO Сокращенное ионное уравнение реакции: Cr3+ + 3OH− = Cr(OH)3↓ 3) Взаимодействие сульфата хрома (III) Cr2(SO4)3 с избытком гидроксида калия KOH с образованием растворимой комплексной соли – тетрагидроксохромита калия K[Cr(OH)4 Молекулярное уравнение реакции: Cr2(SO4)3 + 8KOH(избыток) = 2K[Cr(OH)4] + 3K2SO4 Полное ионное уравнение реакции: 2Cr3+ + 3SO Сокращенное ионное уравнение реакции: Cr3+ + 4OH− = [Cr(OH)4] – В последней реакции произошло связывание катиона Cr3+ с гидроксид-ионами OH− с образованием комплексного тетрагидроксохромит-иона [Cr(OH)4] −.
|
||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 7; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.239.189 (0.007 с.) |

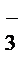 = CaF2↓ + 2Na+ + 2NO
= CaF2↓ + 2Na+ + 2NO 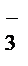
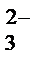 + 2H+ + 2Cl− = 2K+ + 2Cl−+ CO2↑ + H2O
+ 2H+ + 2Cl− = 2K+ + 2Cl−+ CO2↑ + H2O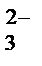 = CO2↑ + H2O
= CO2↑ + H2O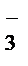 = Na+ + NO
= Na+ + NO 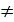
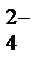 + 3Ba2+ + 6NO
+ 3Ba2+ + 6NO 


