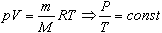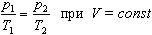Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
где k = 1,38*10 -23 Дж/К - постоянная Больцмана.Содержание книги
Поиск на нашем сайте
где k = 1,38*10 -23 Дж/К - постоянная Больцмана. Связь абсолютной шкалы и шкалы Цельсия: T = t + 273 где t - температура в градусах Цельсия. Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре:
Средняя квадратичная скорость молекул
Учитывая равенство (1), основное уравнение молекулярно-кинетической теории можно записать так: p=nkT P= 2\3nE УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Величину R называют универсальной газовой постоянной, а уравнение, записанное в виде
называют уравнением состояния идеального газа или уравнением Менделеева-Клапейрона. Нормальные условия - давление газа равно атмосферному ( р = 101,325 кПа) при температуре таяния льда ( Т = 273,15 К ). ГАЗОВЫЕ ЗАКОНЫ 1. Изотермический процесс Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим. Если Т =const, то Закон Бойля-Мариотта Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется: p1V1=p2V2 при Т = const График процесса, происходящего при постоянной температуре, называется изотермой.
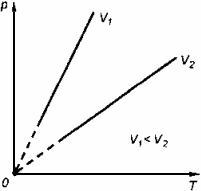
2. Изобарный процесс Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Закон Гей-Люссака Объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре:
Если газ, имея объем V0 находится при нормальных условиях:
Обозначив
получим V=V0 Коэффициент
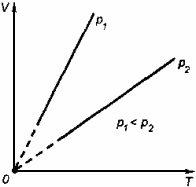
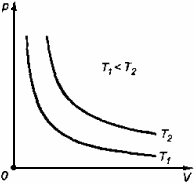
3. Изохорный процесс Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Ecли V = const , то
Закон Шарля Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре:
Если газ, имея объем V0,находится при нормальных условиях:
а затем, сохраняя объем, переходит в состояние с температурой Т и давлением р, то можно записать
График процесса, происходящего при постоянном объеме, называется изохорой.
|
|||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 9; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.105.222 (0.006 с.) |

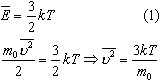
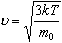
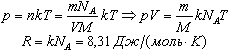
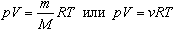
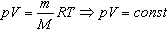
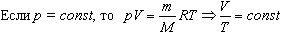
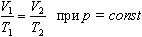
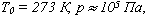 а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать
а затем при постоянном давлении переходит в состояние с температурой Т и объемом V, то можно записать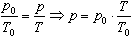
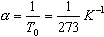
 T
T