
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно – восстановительные реакции
Лабораторная работа №6 Окислительно – восстановительные реакции Цель работы – изучение окислительно-восстановительных свойств веществ, приобретение опыта составления окислительно-восстановительных реакций. Реактивы: растворы с концентрацией 0,1 н.: BaCl2, SnCl2, KI, I2, H2O2, K2Cr2O7; растворы с концентрацией 2 н.: KOH, HNO3, HCl, H2SO4; раствор KMnO4 c концентрацией 0,01 н., хлорная вода; концентрированная серная кислота (96%-ная), концентрированная азотная кислота (60%-ная); сухие вещества: цинк в гранулах, сульфит калия или натрия. Опыт 1. Влияние рН среды на окислительно восстановительный процесс В три пробирки внесите 3-4 капли раствора перманганата калия KMnO4. В первую (чтобы получить рН раствора <7) добавьте 2-3 капли раствора серной кислоты, во вторую (рН раствора >7) добавьте 2-3 капли раствора щелочи, в третьей пробирке (рН 7). Затем в каждую из пробирок внесите по два микрошпателя сульфита натрия Na2SO3 и тщательно размешайте стеклянными палочками до полного растворения кристаллов. Через некоторое время отметьте изменение окраски растворов во всех трех пробирках. Напишите уравнение соответствующих реакций и расставьте коэффициенты методом электронного баланса. Отметить изменение цвета раствора после добавления реактива. 1. KMnO4 + H2SO4 + Na2SO3 → K2SO4 + MnSO4 + Na2SO4 + H2O 2. KMnO4 + KOH + Na2SO3 → K2MnO4 + Na2SO4 + H2O 3. KMn04 + H2O + Na2SO3 → MnO2 ↓ + Na2SO4 + KOH 4. При избытке Na2SO3 K2MnO4 + Na2SO3 + H2O → K2SO4 + MnO2 ↓ + NaOH Опыт 2. Влияние реакций среды на окислительно восстановительный потенциал. В две пробирки поместите по пять капель хромата калия K2CrO4 (раствор желтого цвета) и внесите по 2-3 капли: в одну – раствора серной кислоты, в другую – раствора щелочи. Изменение окраски раствора в одной из пробирок на оранжевую обусловлено переходом иона Контрольные вопросы 1. Что называется степенью окисления элемента? 2. Что происходит с электронами при окислении, восстановлении элемента? 3. Дать определение процессу диспропорционирования. 4. Как относятся понятия «степень окисления» и «валентность» элемента? Библиографический список: 1. Глинка Н.Л. Общая химия: учебное пособие для вузов. / Под ред. А.И. Ермакова. М.: Интеграл-Пресс, 2009. С. 255-262.
|
||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.54.100 (0.007 с.) |
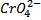 , устойчивого в щелочной среде, в ион
, устойчивого в щелочной среде, в ион 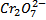 , устойчивый в кислой среде. В каждую пробирку добавьте по нескольку капель нитрита калия. В обоих ли случаях изменилась окраска раствора? В какой среде произошло изменение окислительного числа хрома от +6 до +3 (зеленая окраска характерна для иона Cr3+). Напишите уравнение соответствующих реакций и расставьте коэффициенты методом электронного баланса.
, устойчивый в кислой среде. В каждую пробирку добавьте по нескольку капель нитрита калия. В обоих ли случаях изменилась окраска раствора? В какой среде произошло изменение окислительного числа хрома от +6 до +3 (зеленая окраска характерна для иона Cr3+). Напишите уравнение соответствующих реакций и расставьте коэффициенты методом электронного баланса.


