Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адф + фосфорная кислота + энергия —> атф + водаСодержание книги
Поиск на нашем сайте
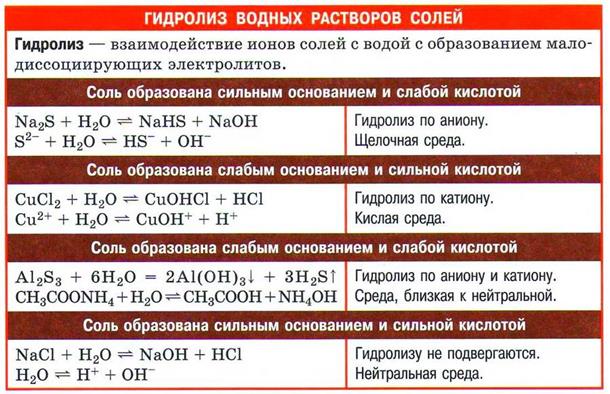
АДФ + фосфорная кислота + энергия —> АТФ + вода Следовательно, процессы гидролиза — химический фундамент процессов ассимиляции и диссимиляции, лежащих в основе жизни на Земле.
Значение гидролиза Гидролиз солей имеет и практическое, и биологическое значение. Еще в древности в качестве моющего средства использовали золу. В золе содержится карбонат калия K2CO3, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов ОН−. В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла — это натриевые и калиевые соли высших жирных карбоновых кислот: стеараты, пальмитаты, которые гидролизуются. Гидролиз стеарата натрия С17Н35COONa выражается следующим ионным уравнением: C17H35COO−+H2O⇄C17H35COOH+OH−, т.е. раствор имеет слабощелочную среду. В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счет повышения рН среды. Соли, создающие необходимую щелочную среду раствора, содержатся в фотографическом проявителе. Это карбонат натрия Na2CO3, карбонат калия K2CO3, бура Na2B4O7 и другие соли, гидролизующиеся по аниону. Если кислотность почвы недостаточна, у растений появляется болезнь — хлороз. Ее признаки — пожелтение или побеление листьев, отставание в росте и развитии. Если рН почвы >7.5, то в нее вносят удобрение сульфат аммония (NH4)2SO4, которое способствует повышению кислотности благодаря гидролизу по катиону, проходящему в почве: NH4++H2O⇄NH3·H2O Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма. Например, в состав крови входят соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды. Это происходит за счет смещения равновесия процессов гидролиза: HCO3−+H2O⇄H2CO3+OH− HPO42−+H2O⇄H2PO4−+OH− Если в крови избыток ионов Н+, они связываются с гидроксид-ионами ОН−, и равновесие смещается вправо. При избытке гидроксид-ионов ОН− равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно. Другой пример: в составе слюны человека есть ионы HPO42−. Благодаря им в полости рта поддерживается определенная среда (рН=7−7.5).
|
||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.209.214 (0.007 с.) |