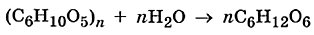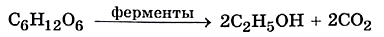Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Атф + вода —> адф + фосфорная кислота + энергияСодержание книги
Поиск на нашем сайте
Приветствую вас, студенты группы Г-120! Сегодня мы поговорим о гидролизе солейисреде водных растворов солей. А также выполним ПР№ 1 Определение рН раствора солей 1. Повторение д/з 1. Что мы называем оксидом? Какие типы оксидов знаете? 2. Из чего состоит соль? Серная и соляная к-ты – общее и отличие 3. Как записывается основание? 4. А что мы называем щелочью? 5. Как записываются неорганические кислоты? 6. Как различаются кислоты?
2. Изучение нового материала Гидролиз Гидролиз (греч. hydor - вода и lysis - разрушение) – процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды. В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» – это правило вам очень пригодится.
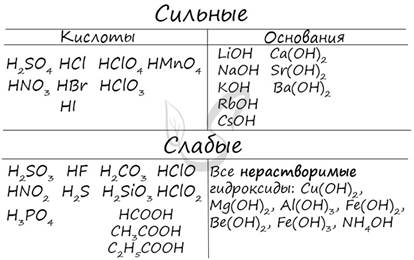
Любая соль состоит из остатка основания и кислоты. Абсолютно любая: o NaCl - производное основания NaOH и кислоты HCl o KNO3 - производное основания KOH и кислоты HNO3 o CuSO4 - производное основания Cu(OH)2 и кислоты H2SO4 o Al3PO4 - производное основания Al(OH)3 и кислоты H3PO4 o Ca(NO2)2 - производное основания Ca(OH)2 и кислоты HNO2 Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие – сильными. При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт – она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем)
Гидролиз бывает необратимым и обратимым.
Если соль образована слабым нерастворимым основанием и слабой летучей кислотой, она существует только в сухом виде, так как в воде полностью разлагается, т. е. подвергается необратимому гидролизу, например: Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑
Кроме некоторых солей, необратимому гидролизу подвергаются многие бинарные (двухэлементные) соединения — фосфиды, нитриды, силициды, гидриды и т. д. Например: Zn3P2 + 6Н2O = 3Zn(OH)2↓ + 2PH3↑ Эта реакция лежит в основе применения фосфида цинка в качестве зооцида, т. е. вещества, используемого для борьбы с животными-вредителями, прежде всего грызунами.
В органической химии необратимый гидролиз используется для получения ацетилена карбидным способом: СаС2 + 2Н2O = Са(ОН)2 + C2H2↑
Результаты опыта, наверное, для вас неожиданны: только во второй пробирке индикаторная бумага показала нейтральную среду, тогда как в первой — щелочную, а в третьей — кислотную. Почему? Объяснить результаты эксперимента нам поможет понятие обратимый гидролиз. Гидролиз солей происходит вследствие взаимодействия катиона металла или аниона кислотного остатка, входящих в состав соли, с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение, в водном растворе появляется избыток катионов водорода или гидроксид–анионов, обусловливающих кислотную или щелочную реакцию среды. Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, карбонат натрия Na2CO3 образован сильным основанием (щёлочью) — гидроксидом натрия NaOH и слабой угольной кислотой Н2СО3.
В зависимости от силы основания и кислоты как электролитов все соли можно разделить на четыре типа. Рассмотрим поведение солей различных типов в водных растворах. ✅ 1. Соли, образованные сильным основанием и слабой кислотой, например карбонат натрия:
Карбонат натрия хорошо растворим в воде и полностью диссоциирует на ионы: Угольная кислота — слабый электролит. Следовательно, катионы водорода прочно удерживаются карбонат–анионом и с трудом отщепляются в раствор. Верно и обратное: карбонат-анион СО32– легко присоединяет катион водорода Н+, отрывая его у молекулы воды. Карбонат-анион при этом превращается в гидрокарбонат, а от молекулы воды в растворе остаётся анион ОН–:
Мы записали ионное уравнение гидролиза. В результате этого процесса в растворе накапливаются гидроксид-анионы, определяющие щелочную реакцию среды. В данном случае говорят, что идёт гидролиз по аниону. Молекулярное уравнение гидролиза карбоната натрия имеет вид ✅ 2. Соли, образованные слабым основанием и сильной кислотой. Рассмотрим пример гидролиза хлорида цинка: В водном растворе хлорид цинка полностью диссоциирует: Гидролизу подвергается тот ион, который принадлежит слабому электролиту, поэтому данная соль гидролизуется по катиону. Отрывая от молекулы воды гидроксид-анион, катион Zn2+ способствует накоплению в растворе катионов водорода:
Молекулярное уравнение гидролиза легко записать, если в ионном уравнении дописать хлорид-анионы:
Реакцию среды в растворе данной соли определяет наличие катионов Н+: среда кислотная. ✅ 3. Соли, образованные слабым основанием и слабой кислотой. Такие соли подвергаются гидролизу по катиону и по аниону. Катион и анион делят между собой молекулу воды, присоединяя соответственно гидроксид–анион и катион водорода. Например, ацетат аммония: В растворе ацетата аммония среда нейтральная, поскольку нет избытка ни катионов водорода, ни гидроксид-анионов. Необратимо гидролизуются и по катиону, и по аниону соли слабого нерастворимого основания и слабой летучей кислоты, что было рассмотрено в начале конспекта. ✅ 4. Не гидролизуются соли, образованные сильным основанием и сильной кислотой. В водном растворе подобных солей катионы металла (щелочного или щёлочноземельного) и анионы кислотного остатка окружены гидратными оболочками, взаимодействия с молекулами воды не происходит, поскольку это не приводит к образованию слабого электролита. Реакция среды в растворе таких солей нейтральная. KNO3+H2O¹ KClO4+H2O¹ Гидролизу подвергается не вся соль, а лишь её часть, т.е. в растворе устанавливается равновесие между солью и образующими её кислотой и основанием. Поэтому часть вещества, подвергающаяся гидролизу, характеризуется степенью гидролиза. Степень гидролиза зависит от константы равновесия, температуры и концентрации соли, а также от её природы. Природа соли проявляется в величине константы гидролиза соли. Константа гидролиза соли Кг характеризует способность данной соли подвергаться гидролизу. Чем больше Кг, тем в большей степени протекает гидролиз (при постоянстве Т и концентрации соли). Константа гидролиза соли, образованной слабой кислотой и сильным основанием, равна: Кг= Константа гидролиза соли, образованной сильной кислотой и слабым основанием, равна: Кг= Константа гидролиза соли, образованной слабой кислотой и слабым основанием, равна: Кг= Зависимость степени гидролиза от концентрации соли проявляется в том, что с разбавлением раствора степень гидролиза растёт. Влияние температуры на степень гидролиза вытекает из рассмотренного ранее принципа Ле Шателье: степень гидролиза растёт с повышением температуры. Поэтому для ослабления гидролиза растворы необходимо хранить концентрированными и при низких температурах. Для солей, образованных сильной кислотой и слабым основанием, фактором подавления гидролиза является подкисление раствора, а в случае соли, образованной слабой кислотой и сильным основанием, таковым фактором является подщелачивание раствора. Процесс гидролиза может протекать ступенчато, например: Na2CO3+H2O=NaHCO3+NaOH CO32- +H2O=HCO3- +OH- I ступень NaHCO3- +H2O=H2CO3+OH HCO3- +H2O=H2CO3+OH- II ступень
Как видно из уравнения реакции гидролиза, в первой ступени образуется гидрокарбонат ион, диссоциация которого характеризуется второй константой диссоциации угольной кислоты, а во второй ступени происходит гидролиз кислой соли с образованием угольной кислоты, диссоциацию которой характеризует первая константа её диссоциации. Поэтому можно связать константу гидролиза по первой ступени К1 со второй константой диссоциации кислоты К2 кисл, а константу гидролиза по второй ступени К2 с первой константой диссоциации кислоты К1 кисл: К1= Гидролиз по первой ступени всегда протекает в большей степени, чем по второй. Аналогично протекает гидролиз соли, образованной слабым основанием многовалентного металла. Особенно глубоко протекает гидролиз соли, образованной слабой кислотой и слабым основанием, т.к. константа гидролиза для этого случая обратно пропорциональна произведению констант диссоциации кислоты и основания, т.е. её значение крайне велико. Согласно протонной теории кислот и оснований гидролиз можно представить как частный случай кислотно-основного равновесия: протон переходит от молекулы воды к данному иону или от данного иона к молекуле воды. Примером может служить гидролиз иона аммония: NH4++H2O= H3О++NH3. Термин «гидролиз» не должен ассоциироваться только с гидролизом солей. Это понятие значительно шире, а гидролиз солей – это лишь небольшая часть химических процессов, связанных с разложением веществ водой. Реакции разложения органических соединений водой также называются гидролизом. Эти реакции играют исключительно важную роль и в промышленности, и в биологических процессах. В курсе органической химии вы изучали гидролиз сложных эфиров, ди- и полисахаридов, белков и других органических веществ. Существует особая отрасль деревообрабатывающей промышленности, которая так и называется — гидролизная. Малоценные отходы лесопереработки (щепа, опилки, стружки), содержащие до 50% органического полисахарида целлюлозы, нагревают при повышенном давлении в присутствии серной кислоты (в качестве катализатора). В результате происходит гидролиз целлюлозы с образованием её мономера — глюкозы:
Полученные глюкозо-содержащие сиропы сбраживают и получают гидролизный этиловый спирт:
Важное значение имеют процессы гидролиза в живой природе. Основными компонентами пищи человека являются жиры, белки и углеводы. В пищеварительном тракте они подвергаются гидролизу с образованием аминокислот, глицерина и жирных кислот, глюкозы. Из этих «строительных кирпичиков» организм синтезирует свои собственные белки, жиры и углеводы. Основу жизненных процессов составляет не только обмен веществ, но и обмен энергии. В энергетическом обмене главную роль играет аденозинтрифосфорная кислота (АТФ). Её молекулы гидролизуются с отщеплением остатков фосфорной кислоты и высвобождением энергии (40—60 кДж/моль):
Энергия расходуется на основной обмен (поддержание температуры, рост клеток, движение и др.). В ходе обратной реакции выделяемая за счёт окисления органических веществ энергия вновь накапливается в АТФ, которая синтезируется из аденозиндифосфорной кислоты (АДФ):
|
||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 7; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.236.178 (0.006 с.) |



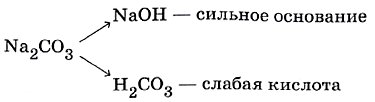
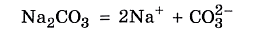
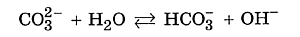
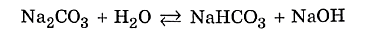

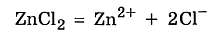
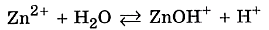
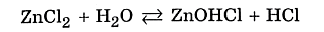
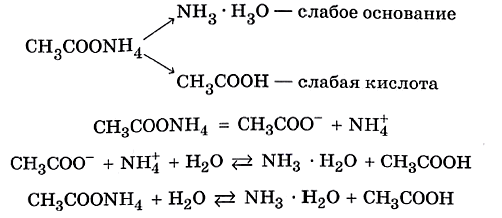
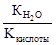 , где Ккислоты – константа диссоциации кислоты. Анализ уравнения показывает, что чем слабее кислота, тем в большей степени подвергаются гидролизу её соли.
, где Ккислоты – константа диссоциации кислоты. Анализ уравнения показывает, что чем слабее кислота, тем в большей степени подвергаются гидролизу её соли.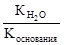 , где Коснования – константа диссоциации основания. Анализ уравнения показывает, что чем слабее основание, тем в большей степени подвергаются гидролизу им образованные соли.
, где Коснования – константа диссоциации основания. Анализ уравнения показывает, что чем слабее основание, тем в большей степени подвергаются гидролизу им образованные соли.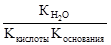 .
.
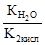 >К2=
>К2= 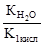 .
.