
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Моль эквивалентов одного вещества реагирует с одним молем эквивалентов другого вещества.Содержание книги
Поиск на нашем сайте Ион
fЭ(SO42–) = 1/2 1.3. Закон эквивалентов Закон эквивалентов был сформулирован в 1800 г так: ''все вещества реагируют в эквивалентных отношениях''. Современное определение закона эквивалентов гласит: Моль эквивалентов одного вещества реагирует с одним молем эквивалентов другого вещества. Распространено определение, позволяющее использовать закон эквивалентов для стехиометрических расчетов без написания и анализа химических уравнений: Массы участвующих в реакции веществ пропорциональны молярным массам их эквивалентов: m1/m2 = Мэ1/Мэ2 (4) Для газов справедливо также определение, использующее молярные объемы эквивалентов: Объемы участвующих в реакции газообразных веществ пропорциональны объемам моля их эквивалентов: V1/V2 = Vэ1∙Vэ2 (5) Поделив массу каждого вещества на молярную массу его эквивалента, получаем: m1/Мэ1=m2/Мэ2 (6) т.е. количества молей эквивалентов, участвующих в реакции веществ, равны между собой. Пример 4. Какую навеску алюминия растворили в кислоте, если объём выделившегося водорода при Т = 291 К и РН2 = 734 мм рт. ст. равен 113 мл? Решение: а) Используя объединенный газовый закон: V0∙Р0 V1∙Р1 ——— = ——— (7) Т0 Т1 находим объем, который занимают 113 мл водорода при нормальных условиях: V1∙Р1∙Т0 113∙734∙273 V0 = ———— = —————— = 103 мл Р0∙Т1 760∙291 Здесь все величины с индексом 1 (Р1, V1, Т1) - данные эксперимента, Р0 - давление при нормальных условиях (760 мм рт. ст.), Т0 - температура при нормальных условиях (273 К) б) Алюминий стоит в 3 группе Периодической системы элементов, окисляется всегда до Аl3+. Следовательно, эквивалент алюминия составляет одну треть его атома ЭАl = 1/3{Аl}. Отсюда молярная масса эквивалентов алюминия составляет одну треть его молярной массы его атомов. МАl = 27/3 = 9 г/моль. Один атом водорода содержит один эквивалент. В молекуле водорода Н2 связано 2 атома. Следовательно Эн2 = ½{Н2}. Объем моля эквивалентов водорода при н.у. Vэ н2 = 22,4/2 = 11,2 л или 11 200 мл По закону эквивалентов рассчитываем навеску алюминия: 9 г Аlвытесняют из кислоты 11 200 мл Н2 Х г Аl вытесняют из кислоты 103 мл Н2 9∙103 Х = ———— = 0,082 г 11 200 Ответ: В кислоте растворили 0,082 г алюминия. Обратите внимание, что при расчетах с применением закона эквивалентов нам нет нужды выяснять, какая конкретно кислота использовалась для растворения, какая соль получилась и по какому уравнению. Пример 5.Сколько граммов марганца можно получить из МnО2, если израсходовано было 3 моль эквивалентов алюминия? Решение. В данной задаче речь идет о получении чистых металлов из их оксидов методом восстановления другим, более активным металлом (алюминием, магнием, кальцием). Это промышленный метод алюмотермии: t 0С 3МnО2 + 2Аl → 3Мn + 2Аl2О3 При расчетах с использованием закона эквивалентов нам не нужно уравнение реакции и не важно, какой именно активный металл использовался. Нужно знать, сколько молей эквивалентов задействовано в реакции и какова молярная масса эквивалента получаемого металла. Если задействовано 3 моль эквивалентов алюминия, то и образуется 3 моль эквивалентов марганца. В данном случае МnО2 → Мn и С.О. марганца меняется от +4 до 0. Фактор эквивалентности fЭ = ¼. Молярная масса эквивалентов марганца МЭ(Мn) = fЭ∙ММn = 55,0/4 = 13,75 г/моль. В реакции задействовано три моля эквивалентов, следовательно, получено 3∙13,75 = 41,25 г Мn. Ответ: Таким методом можно получить 41,25 г марганца
|
||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 68; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.007 с.) |

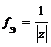 ,где z – заряд иона
,где z – заряд иона


