
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика d -элементов II Б - группы.
Это и определяет стабильность и особенности химических свойств элементов. Элементы IIБ-группы имеют два спаренных электрона на s-подуровне внешнего уровня. Эти электроны и определяют постоянную валентность, равную двум.
Увеличение электроотрицательности в ряду элементов IIБ-группы Zn(1,6)—Сd(1,7)—Нg(1,9) приводит к ослаблению основных и восстановительных свойств, т.е. возрастает неметалличность элемента. Это, в частности, способствует димеризации атомов ртути.
3Нg + 8НNО3 → ЗНg(NО3)2 + 2NО + 4Н2О Zn, Сd, Нg находятся на границе между неметаллами (p-элементами) и металлами (d-элементами), поэтому оксо- и гидроксосоединения Zn, Сd и Нg проявляют амфотерный характер. Амфотерность соединения от Zn к Нg резко уменьшается. Цинк растворяется в щелочи при нагревании. Zn + 2NаОН + 2Н2О → Nа2[Zn(ОН)4] + Н2 Кадмий в тех же условиях не растворяется. Металлы IIБ-группы (так же как их оксиды и гидроксиды) хорошо растворяются в кислотах. Zn и Сd реагируют с разбавленными (содержание меньше 10%) НСl, НNО3, Н2SO4 с выделением водорода. Zn, Сd и Нg с концентрированными НNО3 и Н2SО4 реагируют с выделением NO и SО2. Элементы IIБ-группы являются своеобразным «экватором», при переходе через которых свойства элементов меняются от основных к кислотным. Аналогичное явление наблюдается в случае s-элементов для бериллия, обладающего амфотерными свойствами. Бериллий расположен между металлом Li и неметаллом В. Близость химических свойств Zn и Сd можно объяснить почти равными значениями электроотрицательности элементов, соответственно 1,6 и 1,7. Амфотерный характер элементов IIБ-группы проявляется еще и в том, что цинк, кадмий и ртуть могут находиться не только в гидратированной кати-онной форме [М2+(Н2О)n], где n = 4, 6, но и в анионной [М2+(ОН)n], где n = 4, 6, в том числе и.в виде аутокомплексов: Сd[СdI3], Сd[СdI4], Нg[НgСl3]2, Нg[НgСl4].
|
|||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 32; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.178.133 (0.007 с.) |
 У элементов IIБ-группы (Zn, Сd, Нg) предпоследний электронный слой полностью заполнен, «неспаренных» электронов нет.
У элементов IIБ-группы (Zn, Сd, Нg) предпоследний электронный слой полностью заполнен, «неспаренных» электронов нет. В соединениях элементы этой группы имеют степень окисления +2. Для ртути характерна степень окисления +1 в результате образования атомных димеров Нg22+ (соединения Нg2Сl2, Нg2(NO3)2). В этих димерах связь между атомами ртути неполярна +Нg—Нg+. Поэтому суммарное значение степени окисления равно +1.
В соединениях элементы этой группы имеют степень окисления +2. Для ртути характерна степень окисления +1 в результате образования атомных димеров Нg22+ (соединения Нg2Сl2, Нg2(NO3)2). В этих димерах связь между атомами ртути неполярна +Нg—Нg+. Поэтому суммарное значение степени окисления равно +1.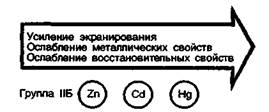 По физическим и химическим свойствам ртуть значительно отличается от цинка и кадмия. Ртуть в электрохимическом ряду напряжений металлов стоит после водорода, поэтому растворяется лишь в кислотах-окислителях:
По физическим и химическим свойствам ртуть значительно отличается от цинка и кадмия. Ртуть в электрохимическом ряду напряжений металлов стоит после водорода, поэтому растворяется лишь в кислотах-окислителях: Цинк, кадмий и ртуть, как и все d-элементы, образуют большое число комплексных соединений. Комплексообразование идет за счет свободных орбиталей ионов металлов и за счет неподеленных пар d-электронов (n—1)-слоя. Для цинка характерно координационное число, например, К2[Zn(ОН)4], К2[НgI4] для кадмия — 4,6, например, [Сd(NН3)6]Сl2.
Цинк, кадмий и ртуть, как и все d-элементы, образуют большое число комплексных соединений. Комплексообразование идет за счет свободных орбиталей ионов металлов и за счет неподеленных пар d-электронов (n—1)-слоя. Для цинка характерно координационное число, например, К2[Zn(ОН)4], К2[НgI4] для кадмия — 4,6, например, [Сd(NН3)6]Сl2.


