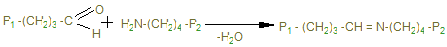Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тропоколлаген, как это представлено на схеме, синтезируется фибробластами в виде проколлагена.Содержание книги
Поиск на нашем сайте
Полипептидные цепи проколлагена имеют дополнительные пептидные участки на концах полипептидных цепей (рис. Превращение проколлагена в тропоколлаген). Эти пептидные участки называются N -концевые и С-концевые пептиды. Схема формирования зрелого коллагенового волокна Фибробласт
отщепление N - и C - поверхности пептида клетки Коллагеновое волокно
поперечных сшивок Зрелое коллагеновое волокно С-концевые пептиды этих цепей предшественников связаны межцепочечными дисульфидными связями, отсутствующими в коллагене. Полипептидные цепи проколлагена с дополнительными пептидами синтезируются в фибробластах и секретируются в межклеточное пространство соединительной ткани. Здесь дополнительные пептиды отщепляются протеолитическими ферментами – проколлагенпептидазами. После их отщепления из образовавшегося тропоколлагена формируется коллагеновое волокно. Причем ряд молекул тропоколлагена смещен по отношению к соседнему ряду молекул примерно на ¼ длины молекулы тропоколлагена (рис. Расположение молекулы тропоколлагена в четыре ряда). Проколлаген
N -концевой пептид С-концевой пептид Проколлагенпептидаза
Тропоколлаген Рис. Превращение проколлагена в тропоколлаген. Перекрывание 64-67 нм
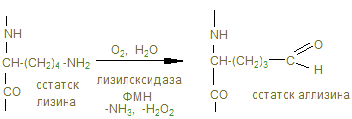
40 нм 400 нм Рис. Расположение молекулы тропоколлагена в четыре ряда. Коллагеновым волокнам свойственно два типа поперечных связей: внутримолекулярные – в пределах одной тропоколлагеновой единицы между N Н и СО и межмолекулярные – между отдельными тропоколлагеновыми единицами. В образовании внутримолекулярных поперечных связей в коллагене участвуют боковые цепи лизина. Внеклеточный медь-содержащий фермент, лизилоксидаза, осуществляет окислительное дезаминирование ε-аминогрупп некоторых лизиловых и гидроксилизиловых радикалов.
Именно они могут образовывать поперечные связи, реагируя с остатками лизина и оксилизина, а также друг с другом, с образованием шиффовых оснований и альдолей - между полипептидами Р1 и Р2.
Эти шиффовы основания подвергаются химической перегруппировке, обеспечивая стабильные ковалентные сшивки. При дефиците лизилоксидазы или нарушении метаболизма меди нарушается образование поперечных связей, что ведет к аномалиям коллагена - причиной наследственных болезней. Наиболее известные среди них: синдром Марфана, синдром Элерса-Данлоса и синдром Менке (синдром курчавых волос). При этом наблюдается дефекты в развитии скелета повышенная растворимость коллагенов, поражения кожи, сосудов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 72; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.008 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

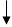
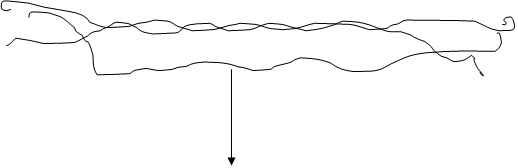
 Пучки Пучки тропоколлагена
Пучки Пучки тропоколлагена проколлагена 5. Гидролитическое 6. Сборка вблизи
проколлагена 5. Гидролитическое 6. Сборка вблизи