
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биохимия соединительной тканиСтр 1 из 6Следующая ⇒
БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ Состав соединительной ткани
Клетки Коллагеновые Межуточное соединительной эластические вещество ткани волокна Главных молекулярных компонента
Соединительная ткань в общей сложности составляет примерно 50% от массы всего тела. Соединительная ткань – это ткань подкожной клетчатки, сухожилий, связок, хрящей, а также органический матрикс костей и зубов, межмышечные фасциальные прослойки. Соединительная ткань окружает кровеносные сосуды, связывает между собой клетки отдельных тканей, заполняя пространство между клетками так называемым основным веществом (внутриорганная строма паренхиматозных органов, нейроглия мозга и т. д.). Соединительная ткань состоит из трех главных элементов (см. схему). 1. Клетки соединительной ткани (фибробласты, хондроциты). По сравнению с другими тканями их мало. Поэтому межуточное вещество занимает больше места, чем клеточные элементы. Коллагеновые, эластические и ретикулярные волокна, расположенные в окружении межуточного вещества. Межуточное вещество (основное вещество), окружающее клетки и волокна соединительной ткани. Существует три главных молекулярных компонента соединительной ткани: два фибриллярных белка – коллаген и эластин, которые в разных соотношениях присутствуют в большинстве видов соединительной ткани, и протеогликаны – молекулы, представляющие собой белки, ковалентно связанные с полисахаридами. Коллаген – это основной белок коллагеновых волокон. Коллагеновые волокна - это морфологические образования, содержащие кроме белка коллагена и другие химические компоненты.
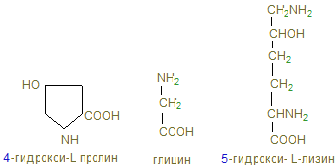
Коллаген имеет специфический аминокислотный состав: примерно 1/3 (33%) аминокислотных остатков приходится на глицин. Количество пролина в коллагене также значительно выше, чем в других белках. Наконец, в коллагене имеются две аминокислоты, которые крайне редко встречаются в других белках, а именно гидроксипролин и гидроксилизин:
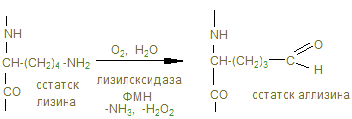
п ролин и гидроксипролин составляют ¼ часть всех аминокислотных остатков и около 1% - гидроксилизин. В коллагене определенная последовательность аминокислот: почти каждый 3-й остаток – это глицин; часто повторяется участок глицин-пролин-гидроксипролин. Основной структурной единицей коллагена является тропоколлаген, молекулярная масса которого составляет около 285000 Д. Тропоколлаген состоит из трех полипептидных цепей одинакового размера. Каждая полипептидная цепь тропоколлагена содержит около 1000 аминокислотных остатков, т.е. основная структурная единица коллагена – тропоколлаген имеет большие размеры, в частности, она в более чем в 10 раз больше химотрипсина. Молекула тропоколлагена имеет форму стержня. Каждая из трех его полипептидных цепей имеет форму левозакрученной α-спирали. Кроме того, эти три спирализованные цепи закручиваются относительно друг друга, образуя тугую правозакрученную нить. Три полипептидные цепи связаны между собой водородными связями, возникающими, в основном, за счет водорода пептидных NH -группы глицина и кислородом пептидных С=О-групп аминокислотных остатков на других цепях. Коллаген синтезируется клетками из свободных аминокислот. Однако, гидроксипролин и гидроксилизин не включаются в состав полипептидной цепи коллагена в процессе биосинтеза коллагена. Эти аминокислоты образуются с участием ферментов соответственно пролингидроксилазы и лизингидроксилазы, а также с участием аскорбиновой кислоты после включения пролина и лизина в полипептидную цепь. Указанные ферменты содержат в активном центре атом железа в фероформе (восстановленное состояние атома железе F е2+). Аскорбиновая кислота выполняет роль восстановительного агента, сохраняя атом железа в фероформе. Остатки гидроксипролина придают структуре дополнительную стабильность за счет образования большого количества внутримолекулярных водородных связей (для этого используются окружающие молекулы воды). В отсутствие аскорбиновой кислоты коллаген оказывается негидроксилированным и поэтому не может образовать нормальные по структуре коллагеновые волокна, что приводит к поражению кожи и ломкости сосудов, столь четко выраженных при цинге.
Фибробласт
отщепление N - и C - поверхности пептида клетки Коллагеновое волокно
поперечных сшивок Зрелое коллагеновое волокно С-концевые пептиды этих цепей предшественников связаны межцепочечными дисульфидными связями, отсутствующими в коллагене. Полипептидные цепи проколлагена с дополнительными пептидами синтезируются в фибробластах и секретируются в межклеточное пространство соединительной ткани. Здесь дополнительные пептиды отщепляются протеолитическими ферментами – проколлагенпептидазами. После их отщепления из образовавшегося тропоколлагена формируется коллагеновое волокно. Причем ряд молекул тропоколлагена смещен по отношению к соседнему ряду молекул примерно на ¼ длины молекулы тропоколлагена (рис. Расположение молекулы тропоколлагена в четыре ряда). Проколлаген
N -концевой пептид С-концевой пептид Проколлагенпептидаза
Тропоколлаген Рис. Превращение проколлагена в тропоколлаген. Перекрывание 64-67 нм
40 нм 400 нм Рис. Расположение молекулы тропоколлагена в четыре ряда. Коллагеновым волокнам свойственно два типа поперечных связей: внутримолекулярные – в пределах одной тропоколлагеновой единицы между N Н и СО и межмолекулярные – между отдельными тропоколлагеновыми единицами. В образовании внутримолекулярных поперечных связей в коллагене участвуют боковые цепи лизина. Внеклеточный медь-содержащий фермент, лизилоксидаза, осуществляет окислительное дезаминирование ε-аминогрупп некоторых лизиловых и гидроксилизиловых радикалов.
Именно они могут образовывать поперечные связи, реагируя с остатками лизина и оксилизина, а также друг с другом, с образованием шиффовых оснований и альдолей - между полипептидами Р1 и Р2.
Эти шиффовы основания подвергаются химической перегруппировке, обеспечивая стабильные ковалентные сшивки. При дефиците лизилоксидазы или нарушении метаболизма меди нарушается образование поперечных связей, что ведет к аномалиям коллагена - причиной наследственных болезней. Наиболее известные среди них: синдром Марфана, синдром Элерса-Данлоса и синдром Менке (синдром курчавых волос). При этом наблюдается дефекты в развитии скелета повышенная растворимость коллагенов, поражения кожи, сосудов. Коллаген VI -го типа образует микрофибриллы, которые локализуется между коллагенами I, II и III -го типов в результате складывания его цепей антипараллельно и в таком виде образованные микрофибриллы секретируются из клетки. Коллаген VII -го типа является основным структурным компонентом «заякоренных фибрилл», которые располагаются в субэпителиальных слоях. Пучки фибрилл, образованных димерами этого коллагена, соединенных «бок о бок» участвуют в присоединении эпидермиса к дерме. Вышеуказанные типы несколько отличаются и своим аминокислотным составом, тип I отличается от остальных низким содержанием гидроксилизина. Остальные содержат много гидроксилизина, кроме типа III, который характеризуется высоким содержанием гидроксипролина. V -й тип отличается низким содержанием аланина, и т.д. При кипячении в воде волокнистый, нерастворимый и неперевариваемый коллаген превращается в желатин – растворимую смесь полипепидов, который в кулинарии используется для приготовления желе. Распад коллагена - единственный источник свободного гидроксипролина в организме, поэтому содержание гидроксипролина в крови и моче отражает баланс скорости катаболизма коллагена. У взрослого человека экскретизируется 15-50 мг гидроксипролина в сутки, при поражении соединительной ткани, например при гиперпаратироидизме с мочой выделяется до 1 г в сутки.
Нативный коллаген не гидролизуется обычными пептидгидролазами. Основной фермент-коллагеназа, расщепляющий пептидные связи в определенных участках спирализованных областей коллагена бывает двух типов. 1. Тканевая коллагеназа синтетизируется клетками соединительной ткани и присутствует у человека в различных органах и тканях. Это металлозависимый фермент, содержит Zn 2+ в активном центре, и активность его определяется действием активаторов (калликреин, плазмин) и ингибиторов. Коллагеназа высокоспецифична и перерезает тройную спираль на ¼ расстояния от С-конца. Нарушение катаболизма ведет к фиброзу органов и тканей (печени и легких), усиление его распада происходит при аутоимунных заболеваниях (ревматоидном артрите и системной красной волчанке) в результате избыточного синтеза коллагеназа при иммунном ответе. 2. Бактериальная коллагеназа синтезируется возбудителем газовой гангрены, которая расщепляет полипептидную цепь более чем 200 местах. В результате разрыва связей перед остатками глицина, микроорганизмы проникают через соединительно-тканные барьеры и способствуют развитию газовой гангрены. Коллагеназа используется для лечения ожоговой болезни и в офтальмологии. Синтез коллагена увеличивается в заживающей ране в результате миграции фибробластов в область раны и синтез ими веществ межклеточного матрикса. На месте раны образуется разновидность соединительной ткани -рубец, основным компонентом которого является коллаген. Аналогично, погибающие клетки печени замещаются соединительной тканью при циррозе, в стенках артерий при атеросклерозе, в мышцах при их дистрофии. Сшивка Эластин находится в больших количествах в стенках кровеносных сосудах и в связках. Катаболизм эластина происходит при участии эластазы нейтрофилов. Особое значение это имеет в легких. Поскольку легочная ткань не регенерирует, разрушение эластина в альвеолярных стенках ведет к потере эластичных свойств и развитию энфиземы легких. В норме это не происходит, так как такие протеазы, как эластаза ингибируется белком α-антитрипсином (α-АТ). При дефиците α-АТ, который может быть следствием различных мутаций в гене этого белка, повышается риск развития энфиземы легких. Следует отметить, что в настоящее время этот белок получен методом генной инженерии и используется в профилактике и лечению внутривенным введением. Протеогликаны образуют межуточное (основное) вещество соединительной ткани, в которое погружены или которым покрыты волокнистые элементы соединительной ткани. Протеогликаны играют роль и межтканевых прослоек и служат смазочным материалом в суставах. Протеогликаны выполняют функцию связывания экстрацеллюлярной воды, а также катионов. Например, они могут фиксировать ионы кальция в очагах оссификации.
Протеогликаны состоят из полисахаридов (примерно 95% молекулы) и белков (примерно 5% молекулы). Гликопротеины состоят из углеводного компонента и белка, но в гликопротеинах преобладает белковый компонент над углеводным. Полисахаридные цепи протеогликанов называются гликозамингликанами или муко-полисахаридами. Поскольку эти вещества преимущественно обнаруживались в слизистых субстанциях, к названию полисахаридов был добавлен префикс “муко”. Позднее термин “муко-полисахариды” был заменен термином “гликозамингликаны”. Полисахариды, как известно, это полимеры, состоящие из моносахаридов, соединенных гликозидными связями. Гликозамингликаны представляют собой линейные неразветвленные полимеры, построенные из повторяющихся дисахаридных единиц. Обязательным компонентом дисахаридной единицы является гексозамин, представленный либо глюкозамином, либо галактозамином. Второй главный мономер представлен гексуроновой кислотой или галактозой. Один из сахаров в дисахариде может иметь отрицательно заряженную карбоксильную или фосфатную группу. Тогда гликозамингликаны называются еще кислотными муко-полисахаридами. Фибронектин - сложный белок - гликопротеин, имеющий доменную структуру и содержащий несколько активных центров связывания (поливалентный белок). Фибронектин, располагаясь в межклеточном пространстве, участвует в структурной организации взаимодействия в соединительной ткани. При недостаточном биосинтезе фибронектина у онкологических больных происходит метастазирование (распространение) опухоли. С возрастом в соединительной ткани уменьшается содержание воды и соотношение основное вещество/волокно. Уменьшение этого коэффициента происходит как за счет нарастания содержания коллагена, так и в результате снижения концентрации гликозамингликанов, особенно гиалуроновой кислоты. Происходят также структурные изменения коллагена. В тропоколлагеновых субъединицах и между ними образуется все большее число поперечных связей, что делает фибриллы коллагена в соединительной ткани более жесткими и хрупкими. Увеличивающиеся хрупкость и жесткость коллагена изменяют механические свойства хрящей и сухожилий, делают более ломкими кости, понижают прозрачность роговицы глаза.
Н ОН Н NH – CO - CH 3 n Остаток D -глюкороновой Остаток N -ацетилглюкозамина кислоты Гиалуроновая кислота БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ Состав соединительной ткани
Клетки Коллагеновые Межуточное соединительной эластические вещество ткани волокна
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 71; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.226.105 (0.037 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Соединительная ткань
Соединительная ткань
 соединительной ткани
соединительной ткани
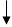
 Пучки Пучки тропоколлагена
Пучки Пучки тропоколлагена проколлагена 5. Гидролитическое 6. Сборка вблизи
проколлагена 5. Гидролитическое 6. Сборка вблизи
















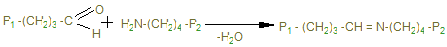

 СООН СН2ОН
СООН СН2ОН
 Н
Н 









 О Н О
О Н О
 О Н Н О
О Н Н О





 ОН Н О Н
ОН Н О Н

 Н НО
Н НО 


