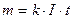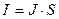Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні положення та означенняСодержание книги
Поиск на нашем сайте 1. Електролітична дисоціація. Чиста дистильована вода — практично діелектрик. Молекули води є природними диполями. Припустимо, що у воді є молекула соляної кислоти НС1. Ця молекула складається з іону Н+ і іону СІ-, які утримуються кулонівською силою притягання. Вода великою мірою ослаблює електричну взаємодію зарядів (приблизно у 80 раз), а молекули води, які хаотично рухаються, вдаряють з усіх боків молекулу соляної кислоти; внаслідок цього молекула НС1 розпадається на іони. Можна сказати, що диполі води оточують молекулу кислоти і ніби розтягають її на іони (рис.19.1). Зауважимо, що різнойменно заряджені іони, які є у воді, притягуються і, зустрівшись, можуть знову утворити молекули. Тому, коли кислота потрапляє у воду, там триває не тільки процес розпаду молекул на іони, а й обернений процес утворення нейтральних молекул з іонів НС1↔Н+ + Сl- (стрілка показують, що процес відбувається в обох напрямах). Розпад молекул на іони під дією розчинника називають електролітичною дисоціацією. Число, яке показує, яку частину всіх молекул розчиненої речовини становлять молекули, що розпалися на іони, називається ступенем дисоціації 2Отже, рухомими носіями зарядів у розчинах є лише іони. Під час дисоціації іони водню і всіх металів заряджені позитивно. Іони в розчині іноді утворюють групу з кількох атомів. Зазначимо, що дисоціацію молекул на іони може спричинити не тільки розчинник. Наприклад, під час значного нагрівання речовини її молекули, які складаються з іонів, можуть дисоціювати на окремі іони. Тому розплави солей також є провідниками електричного струму. 3. Отже, згідно з теорією електролітичної дисоціації, у розчинах солей, кислот і лугів завжди є вільні іони, бо вони виникають у момент розчинення речовини у воді або в іншому розчиннику.
4. Електроліз. Рідкий провідник, в якому рухомими носіями зарядів є лише іони, називають електролітом. Нехай у ванну налито розчин сірчаної кислоти у воді. Молекули сірчаної кислоти дисоціюють згідно з рівняннямH2SO4 ↔ 2Н+ + SO4--. Опустимо у ванну платинові пластини і з'єднаємо їх через амперметр з батареєю. Ці пластини називаються є л є к т р од а м и. Електрод, з'єднаний з позитивним полюсом батареї, називають анодом, а електрод, з'єднаний з негативним полюсом,— катодом. Якщо коло замкнути ключем, то в електроліті між електродами виникне електричне поле. Під дією сил цього поля іони водню Н+ прямуватимуть до катода, а іони кислотного залишку SO4 — до анода. Дійшовши до катода, іони Н+ приєднують до себе один з вільних електронів пластини і перетворюються в нейтральні атоми водню. З'єднуючись попарно, ці атоми утворюють молекули газоподібного водню, який і виділяється на катоді. Встановлено, що в описаному випадку, крім іонів SO4- -, в електроліті є ще інші негативні іони, бо молекули самої води в невеликій кількості також дисоціюють: н2о ↔н+ + он-. Іони ОН- (гідроксил) легко віддають свій зайвий електрон, а іони SO4-- утримують свої електрони міцніше. Тому на аноді, куди підходять негативні іони, розряджаються іони ОН-, а іони SО-- залишаються в розчині. Під час розряджання іонів ОН- утворюється вода і нейтральні молекули газоподібного кисню, який і виділяється на аноді. Позначивши абсолютну величину заряду електрона буквою еу усі ці процеси можна записати так: Утворення іонів у розчині 4Н2О ↔4Н+ + 4ОН--, H2SO4↔2H+ + SO4-- Процеси на катоді Процеси на аноді 4Н+ + 4е = 2Н2 ↑ 4ОН-— 4 е =. 2Н2О + 02 ↑ (Виділяється газоподібний водень) (Виділяється кисень) 5. Отже, з розчину виходять складові частини молекул води, а складові частини молекул кислоти залишаються в розчині. Це означає, що в міру проходження струму кількість води в розчині зменшується, а концентрація розчину зростає. Ось чому описаний процес іноді називають розкладом води електричним струмом. З описаного вище видно, що проходження електричного струму через електроліти супроводжується перетворенням речовини, тобто струм в електролітах чинить хімічну дію 6. Проходження електричного струму через електроліти, яке супроводиться хімічними перетвореннями речовини і виділенням її на електродах, називається електролізом. Посудину з електродами, в якій є електроліт, називають електролітичною ванною. 7. Позитивні іони в розчині називають катіонами (бо під час електролізу вони рухаються до катода), а негативні іони — аніонами. Нагадаємо, що катіонами є іони водню і металів. 8. Перший закон Фарадея. Явище електролізу вивчив М. Фарадей. Вимірюючи величину заряду, що пройшов через розчин, і масу катода до і після електролізу, Фарадей установив, що маса речовини, яка виділяється під час електролізу у прямо пропорційна кількості електрики, що пройшла через розчин: m=k·q Дане твердження є першим законом Фарадея. Досліди Фарадея показали, що маса виділеної під час електролізу речовини залежить не тільки від величини заряду q, а й від роду речовини. 9. Коефіцієнт пропорційності k, який визначає залежність маси виділеної під час електролізу речовини від її роду, називають електрохімічним еквівалентом речовини. Електрохімічний еквівалент вимірюється масою речовини, яка виділяється на електроді під час проходження через електроліт одиниці заряду: k=m/q. (k вимірюється в кг/Кл). Оскільки q == I t, то перший закон Фарадея можна записати так: т = k I t. На досліді електрохімічні еквіваленти можна визначити з великою точністю. 10. Другий закон Фарадея. Частку від ділення молярної маси іонів на їх валентність (М/n) називають хімічним еквівалентом цих іонів В результаті своїх дослідів Фарадей установив, що для виділення на електроді одного хімічного еквівалента іонів будь-якого виду треба пропустити через електроліт однакову кількість електрики F. Цю кількість електрики називають числом Фарадея, або с т а лою Фарадея, F=9,65 · 107 Кл/моль
11. Електрохімічний еквівалент знаходять за формулою: k= (1/F)·(M/n) Дана формула є математичним виразом другого закону Фарадея: електрохімічні еквіваленти різних речовин прямо пропорційні їх хімічним еквівалентам.
Конспект. Розв’язування задач. Модель № 1. (визначення товщини шару покриття)
Див. табл..густин
1.. Під час нікелювання виробів протягом 3 годин відклався шар нікелю товщиною 0,01 мм. Яка густина струму при електролізі? Електрохімічний еквівалент нікелю становить 3·10 -7кг/Кл. Густина нікелю 8,9·103кг/м3. а)12,5А/м2; б)27,5А/м2; в)32,4А/м2; г)2А/м2;
Модель № 2. (визначення кількості молекул у шарі покриття)
m=M·N/NA
Див. табл..Мендєлєєва
2.В електролітичній ванні, що містить розчин АgNOз, проходить струм 10 мА. Скільки атомів срібла виділиться на катоді за 1 секунду? Електрохімічний еквівалент срібла а) 3,1·1010; б)9,5·1014; в)8,2·1016; г) 11,2·1016; д) вірної відповіді тут немає.
Модель № 2. (витрати електричної енергії)
3..Якою є витрата електроенергії для отримання 1 кг алюмінію, якщо електроліз ведеться під напругою 10 В, а ККД установки 80%? Електрохімічний еквівалент алюмінію становить 9,3-10 -8кг/Кл. а) 134,4 МДж; б) 743 МДж; в) 200 МДж; г) 321,5 МДж; д) вірної відповіді тут немає.
Домашнє завдання.
|
|||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 650; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |