Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сухості насиченої водяної париСодержание книги
Поиск на нашем сайте
1 – парогенератор; 2 –електричний нагрівач; 3 – калориметр; 4 – манометр; 5 – термометр; 6 – вентиль.
Досліди необхідно проводити у такій послідовності. Включити електричний нагрівач парогенератора (1). Зважити термостат з водою (3) та заміряти температуру води. Коли тиск у парогенераторі досягне 0,1 МПа, необхідно відкрити кран (6) і подавати пару до термостата так, щоб температура води у ньому підвищилася на 50 – 70 0С від початкової величини температури. Кількість теплоти, що відає пара в процесі конденсації, визначаємо за формулою:
де m – маса сконденсованої пари, кг; ix - ентальпія вологої насиченої пари, кДж/кг; ir – ентальпія води після конденсації в ній пари, кДж/кг; Ентальпія вологої насиченої пари визначається за співвідношенням; де i' – ентальпія киплячої води; r – прихована теплота пароутворення (таблична величина). Ентальпія води після конденсації у ній водяної пари визначається з рівняння: де СРв – теплоємність води.
Тепло,що одержала вода після конденсації вологої насиченої паи, визначається з рівняння:
Контрольні питання
1. Яка пара є вологою насиченою парою? 2. Що таке „ступінь сухості насиченої пари”? 3. Яка пара є сухою насиченою парою? 4. Яка пара є перегрітою водяною парою? 5. Як записати рівняння Клайперона – Клаузіуса? 6. Що таке „прихована теплота пароутворення”? 7. Що називається „фазовою діаграмою”? 8. Які є методи визначення ступеня сухості вологої насиченої пари? 9. Як визначається питомий об'єм, ентальпія, внутрішня енергія та ентропія вологої насиченої пари?
Лабораторна робота №5 ВИЗНАЧЕННЯ ВІДНОШЕННЯ|ставлення| ТЕПЛОЕМКОСТЕЙ| ГАЗУ ЗА МЕТОДОМ КЛЕМАНА-ДЕЗОРМА| Мета роботи: Метою|ціллю||теперішньої,даної| роботи є|з'являється,являється| вивчення процесів, що відбуваються|походять| в газі при вимірюванні|вимірі| відношення|ставлення| питомих теплоємностей| Теоретична частина Питомою теплоємністю газуназивається кількість тепла, необхідне для нагрівання одиниці маси газу на один градус. Величина теплоємності газів залежить від умов їх нагрівання. Запишемо перший початок термодинаміки:
де dQ – кількість тепла, що підводиться до термодинамічної системи і витрачається на збільшення її внутрішньої енергії dU і на роботу dA, що здійснюється|скоюється,чиниться| системою проти|супроти| зовнішніх сил. За визначенням теплоємності
де елементарна робота dA = pdV
Розглянемо|розгледимо| два випадки: 1. Газ нагрівається при незмінному об'ємі|обсязі| V = const. В цьому випадку dV = 0 і робота зовнішніх сил рівна нулю dA = pdV = 0, отже, все передане газу ззовні тепло йде на збільшення його внутрішньої енергії dU. Тоді з|із| рівняння (2) виходить, що теплоємність при постійному об'ємі|обсязі| рівна:
2. Газ нагрівається при постійному тиску|тисненні| p = const. В цьому випадку отримане|отримуване| газом ззовні тепло йде не тільки|не лише| на збільшення його внутрішньої енергії dU, але і на здійснення газом роботи dA проти|супроти| зовнішньої сили тиску|тиснення|. Тоді теплоємність при постійному тиску|тисненні| рівна:
Отже, для нагрівання одиниці маси газу на один градус при p = const буде потрібно більше тепла, ніж при V = const. Знайдемо зв'язок між Ср і Сv. Скориставшись рівнянням стану ідеального газу для одиниці маси ідеального газу, отримаємо|отримаємо|:
При p = const, dp = 0, і тоді
Підставивши цей вираз в (4) і замінивши dU/dT на Cv згідно (3) (для одиниці маси), отримаємо|отримаємо|:
Таким чином, питома теплоємність Ср більше питомої теплоємності Сv на величину R/μ, яка є роботою, що здійснюється|скоюється,чиниться| одиницею маси газу при розширенні, що відбувається|походить| при постійному тиску|тисненні| в результаті|унаслідок,внаслідок| підвищення його температури на один градус. Разом з|поряд з,поряд із| питомою теплоємністю с|із|, часто користуються молярною теплоємністю C (теплоємність одного кіломоля речовини). Між ними є|наявний| очевидне співвідношення
Тоді співвідношення ( 6 ) можна записати у вигляді|виді|:
Згідно закону рівнорозподілення| енергії за ступенями вільностіна кожну ступінь вільності молекули ідеального газу доводиться|припадає,приходиться| в середньому однакова енергія, рівна 1/2kT (k – постійна Больцмана). Тому внутрішню енергію одного кіломоля ідеального газу можна знайти за формулою:
де NА – число Авогадро, i – число ступенів вільності молекули газу. Підставивши цей вираз в (3), отримаємо|отримаємо|:
Число ступенів вільності визначається числом атомів в молекулі і характером|вдачею| зв'язку між ними. Для одноатомного газу i = 3; для двоатомного – i = 5 (жорсткий зв'язок), i = 6 (пружний зв'язок); для трьох і більш атомів в молекулі i = 6 (жорсткий зв'язок, нелінійна молекула). Оскільки|тому що|
то
і
Величини cp і cv можна визначити експериментально. Проте|однак| існує спосіб безпосереднього визначення відношення|ставлення| cp/cv = γ яке залежить тільки|лише| від числа ступенів вільності молекул газу. Це відношення|ставлення| входить у вираз|вираження| закону Пуассона, що описує адіабатичний процес в газах.
Адіабатичним процесомназивається процес, що протікає без теплообміну з|із| навколишнім середовищем. Такий процес відбуватиметься|походитиме| в системі, оточеній абсолютно|цілком| нетеплопровідними стінками. Оскільки|тому що| абсолютно|цілком| нетеплопровідних стінок не буває, реально процес може лише наближатися до адіабатичного. Якщо процес протікає достатньо|досить| швидко, так що система не встигає|устигає| вступити в теплообмін з|із| навколишнім середовищем, то його можна рахувати практично адіабатичним і за відсутності хорошої|доброї| теплової ізоляції (наприклад, при швидкому стисненні|стискуванні| або розширенні газу). Перший початок термодинаміки для адіабатичного процесу приймає вигляд|вид|:
тобто|цебто| при адіабатичному розширенні робота здійснюється|скоюється,чиниться| газом тільки|лише| в результаті|унаслідок,внаслідок| зміни запасу його внутрішньої енергії. Адіабатичне розширення супроводжується|супроводиться| пониженням температури, а адіабатичне стиснення|стискування| – підвищенням температури. Виведемо рівняння адіабатичного процесу (рівняння Пуассона). Оскільки dA = pdV, то, використавши вираз|вираження| (8), знайдемо
Поділивши рівняння (5) на (9) і взявши до уваги, отримаємо|отримаємо|
звідки
де
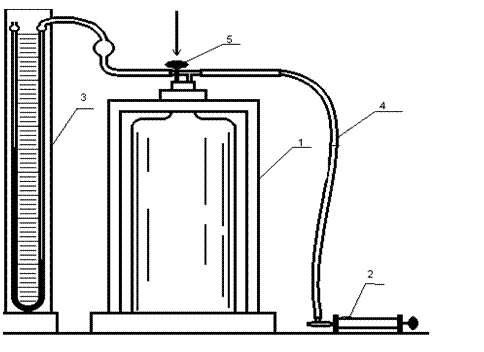
Після|потім| інтеграції і потенціювання (10) одержимо|отримаємо| рівняння Пуассона PV2 = const Прилад Клемана-Дезорма, за допомогою якого можна визначити величину ср/сv (рис4.1). Він є балоном (1) на 10 л з|із| повітрям, яке накачується ручним насосом (2) до деякого тиску|тиснення| p, надлишок якого h = p – p0 над атмосферним p0 визначається по водяному манометру (3), який сполучається з балоном (1) гумовим шлангом (4). Для здійснення швидкого (адиабатного|) розширення повітря з|із| балона (1) до атмосфери служить клапан (5).
Рис.4.1.Схема установки Клемона – Дезорма для визначення відношення теплоємностей газу 1- балон; 2 – ручний насос; 3 - водяний манометр; 4 – гумовий шланг; 5 – клапан. Виділимо (у думках) усередині повітря, що знаходиться|перебуває| в балоні (1), деяку масу m і простежимо за зміною її стану під час експерименту|досліду| при одночасній зміні тиску|тиснення| p і температури T. Якщо клапан (5) відкритий|відчинений|, то тиск|тиснення| в судині|посудині| рівний атмосферному P0; температура повітря в судині|посудині| рівна T0 – температурі навколишнього середовища. Тоді параметрами виділеної в думках маси повітря будуть, V0, T0, P0 де V0 – об'єм|обсяг| даної маси повітря при тиску|тисненні| P0 і температурі T0. Якщо тепер закрити|зачинити| клапан (5) і накачати за допомогою насоса в судину|посудину| деяку кількість повітря, то маса повітря, що розглядається|розглядується| нами, стиснеться|стискуватиметься|, а температура і тиск|тиснення| її підвищаться. Через деякий час у наслідок|внаслідок| теплообміну з|із| навколишнім середовищем температура повітря в судині|посудині| стане рівною T0. Тиск|тиснення| же буде рівний:
де h1 – остаточна (після|потім| встановлення теплової рівноваги з|із| навколишнім середовищем) різниця рівнів рідини в манометрі. Стан даної маси повітря визначається тепер параметрами V1 , P1, T0 – це I стан виділеної маси повітря; V1 – об'єм|обсяг| даної маси повітря при тиску|тисненні| P1 і температурі T0. Якщо на короткий час (~ 1-2 с|із|) відкрити|відчинити| клапан (5), то повітря, що знаходиться|перебуває| в балоні, швидко (за адіабатою) розшириться і внаслідок цього охолоджується. В кінці|у кінці,наприкінці| цього малого проміжку часу, протягом якого клапан (5) відкритий|відчинений|, і балон сполучається з атмосферою, тиск|тиснення| повітря у середині судини|посудини| стане рівним тиску|тисненню| атмосфери, і стан даної маси повітря визначатиметься у цей момент наступними|такими| параметрами, V2, P0, T1 – це II стан виділеної маси повітря; V2 – об'єм|обсяг| даної маси повітря при тиску|тисненні| P0 і температурі T1. При цьому Коли тиск|тиснення| в судині|посудині| (1) стане|чинитиметься| рівним тиску|тисненню| атмосфери P0 (через 1-2 с|із|), клапан (5) закривають|зачиняють|. Повітря, що знаходиться|перебуває| в балоні (1), починає|розпочинає,зачинає| нагріватися від T1 до T0 у наслідок|внаслідок| отримання|здобуття| тепла від навколишнього середовища, тиск|тиснення| в судині|посудині| починає|розпочинає,зачинає| підвищуватися і стане рівним:
де h2 – різниця рівнів рідини в манометрі після того, як температура газу в балоні стане рівній температурі навколишнього середовища. Дана маса повітря тепер характеризується параметрами V2, P2, T0 – це III стан даної маси повітря. Отже, дана маса повітря під час експерименту знаходилася|перебувала| послідовно в трьох станах:
Перехід із стану I в стан II відбувається адіабатно, із стану II в – стан III – ізохорно.
Рис.4.2.Графіки процесів. На Рис4.2. зображені|змальовані| графіки процесів: крива I-II – адіабата, крива II-III – ізохора, крива III-I – ізотерма. Газ в станах I-III має однакову температуру. Перехід із|із| стану I в стан II описується рівнянням Пуассона:
Параметри станів I і III задовольняють закону Бойля-Маріотта:
Піднісши рівняння (15) до ступеня g і розділивши його за членами| на (14), отримаємо|отримаємо|:
Звідси
Враховуючи рівність (12) і (13), отримаємо|отримуємо|, що
і, підставляючи їх в рівність (16), маємо
Оскільки|тому що|
Прирівнявши праві частини|частки| (17) і (18), отримаємо|отримаємо| наступну|слідуючу| формулу:
яка і використовується в цій роботі для експериментального визначення g. Порядок|лад| виконання роботи
1. При закритому|зачиненому| клапані (5) ручним насосом (2) обережно накачують повітря в балон (1) до різниці рівнів рідини в манометрі 30 ¸ 35 см. 2. Вичікують 2 ¸ 3 хвилини, поки|доки| рівні рідини в манометрі не перестануть змінюватися; потім розраховують їх різницю h1 з точністю до|із точністю до| 1 мм. 3. Натискаючи|натискуючи| рукою на клапан (5), відкривають|відчиняють| його; при цьому чується шипіння повітря, що виходить з|із| балона (1). Клапан (5), залишається відкритим|відчиненим| протягом 1 ¸ 2 секунд, поки|доки| не припиниться шипіння повітря, що виходить з|із| балона (1), після чого клапан (5) закривають|зачиняють|. 4. Вичікують 2 ¸3 хвилини, стежачи за зміною рівнів рідини в манометрі; коли рівні встановляться, розраховують їх різницю h2 з точністю до|із точністю до| 1 мм. 5. Опит|дослід| проробляють 10 разів. Результати вимірювань|вимірів| записують|занотовують| в табл. 4.1. Таблиця 4.1.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 519; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.119.149 (0.012 с.) |

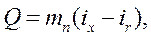


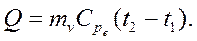
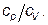

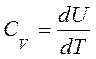 .
.
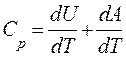 .
.
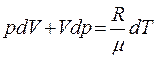
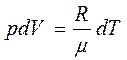
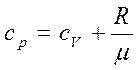
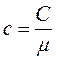

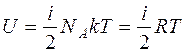 ,
,
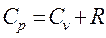 або
або 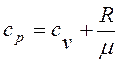
 або
або 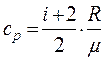

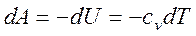
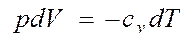 .
.
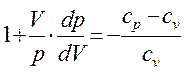
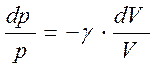

 ,
,
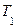 <
<  .
. ,
,
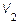 ,
,

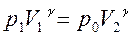
 .
.
 ,
,
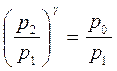 ,
,
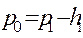 ,
,
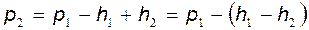

 .
.