
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обладнання , прилади, реактивиСодержание книги Поиск на нашем сайте
Титрувальний стіл, бюретки об’ємом 100 мл, конічні колби об’ємом 250 мл, мірний циліндр об’ємом 100 мл. Реактиви: аміачно-буферний розчин, розчин хромогена чорного, розчин мурексиду, розчин трилона Б (0,1н), розчин їдкого натрію (10%).
Порядок проведення роботи
Визначення сумарного вмісту кальцію і магнію У конічну колбу об’ємом 250 мл відбирають 100 мл досліджуваної води, додають 5 мл аміачно-буферного розчину, 7-8 крапель розчину хромогену чорного і титрують 0,1 н розчином трилону Б, інтенсивно перемішуючи воду у колбі. До кінця титрування забарвлення води переходить від винно-червоного до фіолетового, після чого розчин трилону Б додають по одній краплі до переходу забарвлення у синій колір (до точки еквівалентності). Сумарний склад кальцію і магнію розраховують за формулою:
де а – кількість трилону Б, що пішла на титрування; н – нормальність трилону Б; V – об’єм води, взятої для аналізу в мл. Визначення вмісту кальцію У конічну колбу на 250 мл відбирають такий же об’єм досліджуваної води, як для сумарного визначення кальцію і магнію. Додають 2 мл 10% розчину їдкого натрію. Додають 0,2-0,3 г (або 5 крапель) порошку мурексиду і титрують розчином трилону Б на білому фоні до переходу рожево-червоного кольору у фіолетовий. Зміна забарвлення проходить поступово, але перехід від блідо-рожевого до фіолетового досить різкий. Склад кальцію визначають за формулою:
або
де 20 – еквівалентна вага кальцію. н – нормальність трилону Б; а – кількість трилону Б, що пішла на титрування в мл. V – об’єм води, взятої для аналізу в мл.
Визначення вмісту магнію Вміст магнію визначають розрахунковим шляхом, як різницю між сумою кальцію і магнію та кальцієм.
де 12,2 – еквівалентна вага магнію;
Оформлення звіту
Результати визначень записують у формі таблиці: Таблиця 3.1.
Контрольні запитання
1 Яким методом визначається вміст кальцію і магнію у підземних водах? 2 Зміст трилонометричного методу визначення вмісту кальцію і магнію у підземних водах? 3 Який індикатор застосовується при титруванні для визначення вмісту суми кальцію і магнію у підземних водах? 4 З якими іонами спочатку вступає в реакцію трилон Б при титруванні досліджуваної води? 5 Як проводиться визначення сумарного вмісту кальцію та магнію у підземних водах? 6 Як проводиться визначення вмісту кальцію у підземних водах? 7 Як проводиться визначення вмісту магнію у підземних водах?
Література 1 Дубей Н.В. Гідрогеологія та інженерна геологія. Підручник для ВНЗ. Івано-Франківськ. – електронний варіант.2009.-262с. 2 Карцев А.А. Гидрогеология нефтяных и газовых месторождений. - М.: Недра, 1972. – 280с. 3 Климентов П.П., Богданов Г.Я. Общая гидрогеология. - М.: Недра, 1977. – 357с. 4 Колодій В.В., Колодій І.В., Маєвський Б.Й. Нафтогазова гідрогеологія. Підручник для ВНЗ.- Івано-Франківськ: Факел, 2009.- 184с.
Лабораторна робота №4
ВИЗНАЧЕННЯ ЗАГАЛЬНОЇ ЛУЖНОСТІ ПІДЗЕМНИХ ВОД
Мета і завдання роботи
Визначення загальної лужності підземних вод проводиться методом титрування проб води соляною кислотою. Це надійний метод, але не дає точного роздільного визначення карбонатів і бікарбонатів, оскільки лужність визначається рядом аніонів слабих кислот, а при титруванні карбонатів титруються й інші аніони слабих кислот. Крім того, із-за переходу вуглекислоти в газову фазу неперервно змінюється карбонатна рівновага і співвідношення у складі карбонатів і бікарбонатів.
Обладнання,прилади, реактиви
Титрувальний стіл, колби об’ємом 250 мл, піпетки об’ємом 100 мл. реактиви: розчин фенолфталеїну (1% спиртовий), розчин метилоранжу, розчин соляної кислоти (0,1н). Порядок проведення роботи
Лужність пластових вод обумовлюється наявністю солей слабих кислот, в основному карбонатів і бікарбонатів лужно-земельних і лужних металів. Розрізняють лужність по фенолфталеїну ( Для визначення загальної лужності 100 мл профільтрованої досліджуваної води наливають в конічну колбу об’ємом 250 мл, додають 10 крапель 1% спиртового розчину фенолфталеїну.У випадку появи малинового забарвлення проводять титрування 0,1н розчином соляної кислоти до переходу забарвлення розчину від малинового до прозорого. Потім до проби додають 3 – 4 краплі метилоранжу і титрують до переходу жовтого кольору в оранжевий. вміст або
Вміст або
де а – розхід розчину соляної кислоти в мл при титруванні по фенолфталеїну; b – розхід розчину соляної кислоти в мл при титруванні по метилоранжу; н – нормальність розчину соляної кислоти; 61 – еквівалентна вага 30,5 – еквівалентна вага Якщо при додаванні до води фенолфталеїну рожевий колір не появляється – це вказує на відсутність у воді іонів Якщо при титруванні по фенолфталеїну витрачається більше кислоти, ніж при титруванні по метилоранжу – це значить, що досліджувана вода має іон При титруванні по метилоранжу відтитровується іон Якщо “a” – розхід (мл) розчину соляної кислоти, який витрачається на титрування по фенолфталеїну, а “b” – розхід (мл) розчину соляної кислоти, що витрачається на титрування по метилоранжу, то при “a” більше “b”
або
або
де V - об’єм проби взятої для аналізу.
Оформлення звіту результати визначення записують у формі таблиці: Таблиця 4.1.
Контрольні запитання 5 Суть методу визначення загальної лужності титруванням проб води кислотою? 6 Чому в підземних водах змінюється співвідношення вмісту карбонатів і бікарбонатів у процесі тривалого зберігання проб води? 7 Чим обумовлена лужність підземних вод? 8 Як проводиться визначення загальної лужності підземних вод? 9 Що вказує на відсутність у воді іонів 10 Напишіть формулу розрахунку вмісту в воді іону 11 Напишіть формулу розрахунку вмісту в воді іону 12 За яких умов титрування досліджувана вода має іони Література 1 Дубей Н.В. Гідрогеологія та інженерна геологія. Підручник для ВНЗ. Івано-Франківськ. – електронний варіант.2009.-264с. 2 Карцев А.А. Гидрогеология нефтяных и газовых месторождений. - М.: Недра, 1972. – 280с. 3 Климентов П.П., Богданов Г.Я. Общая гидрогеология. - М.: Недра, 1977. – 357с. 4 Колодій В.В., Колодій І.В., Маєвський Б.Й. Нафтогазова гідрогеологія. Підручник для ВНЗ.- Івано-Франківськ: Факел, 2009.- 184с.
Лабораторна робота № 5
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 318; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |

 (3.1)
(3.1) – сумарний склад кальцію і магнію в мг-екв/л;
– сумарний склад кальцію і магнію в мг-екв/л; мг-екв/л (3.2)
мг-екв/л (3.2) мг/л (3.3)
мг/л (3.3) мг-екв/л (3.4)
мг-екв/л (3.4) мг/л (3.5)
мг/л (3.5) ) і метилоранжу (
) і метилоранжу ( ).
). мг-екв/л, (4.1)
мг-екв/л, (4.1)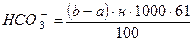 мг/л. (4.2)
мг/л. (4.2) 
 мг-екв/л, (4.3)
мг-екв/л, (4.3) мг/л, (4.4)
мг/л, (4.4) і
і  =Н2О і
=Н2О і  мг-екв/л, (4.5)
мг-екв/л, (4.5)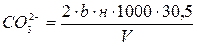 мг/л, (4.6)
мг/л, (4.6) мг-екв/л, (4.7)
мг-екв/л, (4.7) мг/л, (4.8)
мг/л, (4.8) )
)
 )
)



