
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дубей Н.В. Гідрогеологія та інженерна геологія. Підручник для ВНЗ. Івано-Франківськ. – електронний варіант.2009.-262с.Содержание книги
Поиск на нашем сайте 2 Карцев А.А. Гидрогеология нефтяных и газовых месторождений. - М.: Недра, 1972. – 280с. 3 Климентов П.П., Богданов Г.Я. Общая гидрогеология. - М.: Недра, 1977. – 357с. 4 Колодій В.В., Колодій І.В., Маєвський Б.Й. Нафтогазова гідрогеологія. Підручник для ВНЗ.- Івано-Франківськ: Факел, 2009.- 184с.
Лабораторна робота №2
ВИЗНАЧЕННЯ ВМІСТУ ХЛОР-ІОНІВ В ПІДЗЕМНИХ ВОДАХ
Мета і завдання роботи
Визначити вміст хлор-іонів в підземних водах аналітичним шляхом.
Основні теоретичні положення Визначення хлор-іонів проводиться титруванням Для питної води границя допустимої концентрації хлоридів складає 350 мг/дм³.
Обладнання, прилади, реактиви Титрувальний стіл, бюретка об’ємом 10 мл, колба об’ємом 250 мл. Реактиви: розчин хромовокислого калію Порядок проведення роботи
Проводять два визначення хлор-іонів: орієнтовне і точне. Якщо за даними орієнтовного визначення вода має багато хлоридів, воду для точного визначення відбирають з таким розрахунком, щоб на одне визначення пішло 3-20 мл 0,1н розчину азотнокислого срібла.
Орієнтовне визначення: в пробірку наливають 5 мл досліджуваної води, додають одну краплю 10% розчину хромовокислого калію. Потім, постійно перемішуючи, добавляють по краплях 0,1н розчин азотнокислого срібла до незникаючого бурого кольору. При множенні числа використаних крапель на 0,02 одержують приблизно склад хлор-іону в розчині, виражений в г/л. Точне визначення: якщо при орієнтовному визначенні вміст хлор-іону не перевищує 0,400 г/л, точне визначення проводиться в 100 мл води. При більш високому вмісті хлоридів для визначення відбирають відповідно менший об’єм, або користуються точно розведеним вихідним розчином. До відміряного об’єму (100 мл) досліджуваної води додають 5 крапель хромату калію і повільно титрують при неперервному перемішуванні 0,1н розчином азотнокислого срібла до переходу жовтуватого кольору у розовато-бурий, що не зникає при перемішуванні. При титруванні рекомендується порівнювати колір досліджуваної води з кольором стандарту, який готується додаванням повареної солі до відтитрованої проби. Від добавки повареної солі бурий колір розчину переходить в світлий, в зеленувато-жовтий. Визначення хлоридів за цим методом правильно тільки в тому випадку, коли рН розчину, в якому визначають хлор-іон, не менше 7 і не більше 10,5. Якщо рН розчину більше 10,5, тоді до проби розчину, відібраної для визначення іону хлору, додають 2-3 краплі 0,1 % розчину фенолфталеїну і по краплях розведену (не менше 1:5) азотну кислоту для прозорості розчину. Якщо досліджувана вода має кислу реакцію, то таку пробу нейтралізують 0,1н розчином їдкого натрію, застосовуючи в якості індикатора той же розчин фенолфталеїну і обезбарвлюють потім воду однією краплею азотної кислоти. Якщо вода має у собі сірководень, від нього звільняються кип’ятінням її в азотнокислому середовищі. Кількість хлор-іонів розраховують так:
де а – кількість розчину азотнокислого срібла у мл, витрачене на титрування, н – нормальність розчину азотнокислого срібла, V – об’єм проби взятої для титрування (з врахуванням розведення), 35,5 – еквівалентна вага хлору.
Оформлення звіту результати досліджень записують у формі таблиці: Таблиця 2.1.
Контрольні запитання 1 Яким методом визначаються хлор-іони у природній воді? 2 Що вказує на кінець титрування? 3 Для чого проводять орієнтовне визначення вмісту хлор-іону у досліджуваній воді? 4 Як проводять точне визначення вмісту хлор-іону у досліджуваній воді? 5 За яких умов визначення хлоридів методом титрування може бути правильним? 6 За яких умов до проби води, відібраної для визначення іону хлору додають 2 – 3 краплі 0,1 % розчину фенолфталеїну? 7 За яких умов до досліджуваної води додають розчин їдкого натрію? 8 Як звільнити досліджувану воду від розчиненого в ній сірководню? 9 За якою формулою розраховується кількість хлор-іонів у воді?
Література 1 Дубей Н.В. Гідрогеологія та інженерна геологія. Підручник для ВНЗ. Івано-Франківськ. – електронний варіант.2009.-264с. 2 Карцев А.А. Гидрогеология нефтяных и газовых месторождений. - М.: Недра, 1972. – 280с. 3 Климентов П.П., Богданов Г.Я. Общая гидрогеология. - М.: Недра, 1977. – 357с. 4 Колодій В.В., Колодій І.В., Маєвський Б.Й. Нафтогазова гідрогеологія. Підручник для ВНЗ.- Івано-Франківськ: Факел, 2009.- 184с.
Лабораторна робота №3
ВИЗНАЧЕННЯ ВМІСТУ МАГНІЮ І КАЛЬЦІЮ У ПІДЗЕМИХ ВОДАХ
Мета і завдання роботи
Визначення кальцію і магнію у підземних водах проводиться трилонометричним методом. Даний метод є найбільш простим і точним. Однак варто пам’ятати, що точність визначення кальцію у два рази перевищує точність визначення магнію і похибки у визначенні кальцію автоматично посилюють похибки у визначенні магнію (у випадку завищення складу кальцію склад магнію занижується і навпаки).
Основні положення
Від вмісту у воді кальцію і магнію залежить її твердість. Загальна твердість відповідає сумарному вмісту іонів Са2+ і Mg2+. Твердість підземних вод має велике значення при їх оцінці для практичного використання. Для питної води загальна твердість повинна складати 3-7 мг-екв/л. Трилонометричне визначення засновано на реакції взаємодії іонів кальцію і магнію з трилоном Б з утворенням стійких з’єднань, добре розчинених у воді. В якості індикатора для титрування при визначенні суми кальцію і магнію застосовують хромоген чорний ЕТ-00. У присутності іонів кальцію і магнію у досліджуваному розчині індикатор утворює у лужному середовищі при рН=10-12 комплексне з’єднання, яке забарвлює розчин у винно-червоний колір. При титруванні досліджуваного розчину трилон Б спочатку вступає в реакцію з іонами кальцію, а потім з іонами магнію. У точці еквівалентності червоне забарвлення індикатора переходить в синє. В іншому рівному об’ємі досліджуваного розчину титрують трилоном Б кальцій також в лужному середовищі з індикатором мурексидом, який являє собою амонійну сіль пурпурної кислоти. У точці еквівалентності рожево-червоний колір переходить у фіолетовий.
|
||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 354; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

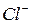 – іона 0,1н розчином азотнокислого срібла в присутності індикатора хромовокислого калію. Перша крапля надлишкового розчину срібла утворює з індикатором осад хромовокислого срібла, що забарвлює розчин у кров’яно-бурий колір. Зміна кольору титрованого розчину від зеленувато-жовтого до кров’яно-бурого вказує на кінець титрування.
– іона 0,1н розчином азотнокислого срібла в присутності індикатора хромовокислого калію. Перша крапля надлишкового розчину срібла утворює з індикатором осад хромовокислого срібла, що забарвлює розчин у кров’яно-бурий колір. Зміна кольору титрованого розчину від зеленувато-жовтого до кров’яно-бурого вказує на кінець титрування.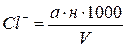 мг-екв/л (2.1)
мг-екв/л (2.1)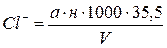 мг/л, (2.2)
мг/л, (2.2)


