
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Четвертая аналитическая группа катионовСодержание книги
Поиск на нашем сайте
9. Катион Zn2+ - в водных растворах бесцветен. А. Определяется по реакции с сероводородом или сульфидом натрия при рН~2 с образованием белого осадка сульфида цинка:
Ход анализа. К нескольким каплям соли цинка добавить сероводородную воду или раствор сульфида натрия до выпадения белого осадка сульфида цинка. Б. В отсутствие железа присутствие ионов цинка определяют по реакции с гексацианоферратом (II) калия K4[Fe(CN)6] («желтой кровяной солью»). При этом образуется белый осадок двойной соли – гексацианоферрата (II) цинка-калия, растворимый в щелочах:
Эта реакция отличает Zn2+ от Al3+, который с K4[Fe(CN)6] осадка не образует. Ход анализа. К нескольким каплям соли цинка добавить гексацианоферрат (II) калия до выпадения белого осадка. В. В отсутствие солей кобальта, никеля и железа, цинк определяют по реакции с тетрароданомеркуриатом аммония (NH4)2[Hg(CNS)4], приводящей к образованию белого осадка тетрароданомеркуриата цинка:
Примечание. Данную реакцию ведут в слабокислой среде (pH = 5), т.к. осадок Zn[Hg(CNS)4] в сильных кислотах растворим, а под действием щелочей применяемый реагент (NH4)2[Hg(CNS)4] разлагается с образованием желтого осадка HgO. Ход анализа. К нескольким каплям соли цинка добавить тетрароданомеркуриат аммония до выпадения белого осадка. 10. Катион Cr3+. Растворы солей хрома (III) имеют зеленую окраску. Растворы солей хрома (VI), в щелочных средах представленные хроматами
с последующей его идентификацией. При наличии в растворе сульфат-ионов, проверка раствора на наличие в нем ионов хрома выполняется способами Б или В. A. По реакции с хлоридом бария (или нитратом свинца (II)), приводящей к образованию желтого осадка хромата бария (свинца):
Ход анализа. К 2-3 каплям раствора соли хрома (III) добавить щелочь до полного растворения образующегося осадка гидроксида хрома (III), а затем 5-7 капель 30 % раствора пероксида водорода и кипятить до исчезновения мелких пузырьков. Желтый цвет полученного раствора свидетельствует о полном окислении хрома (III). К полученному желтому раствору добавить раствор соли бария или свинца до выпадения желтого осадка хромата. Б. Перевод хромат-ионов в дихромат-ионы в кислой среде по реакции:
Образующийся по реакции дихромат калия имеет оранжевую окраску. В избытке добавляемой кислоты, т.е. в сильнокислых растворах, возможен переход окраски из оранжевой в красную за счет образования полихроматов: Ход анализа. К 2-3 каплям раствора соли хрома (III) добавить избыток 6 н. раствора щелочи, 5-7 капель 30 % раствора пероксида водорода и прокипятить. К полученному желтому раствору хромата калия добавить по каплям раствор серной кислоты до перехода окраски в оранжевую и красную. В. Перевод дихромата в надхромовую кислоту перекисью водорода в присутствии амилового спирта:
Надхромовая кислота имеет синий цвет. В водных растворах быстро разлагается с образованием зеленого раствора хрома (III), поэтому соответствующую реакцию проводят в присутствии амилового спирта, в котором раствор надхромовой кислоты значительно устойчивее. Ход анализа. К 2-3 каплям раствора соли хрома (III) добавить избыток 6 н. раствора щелочи, 5-7 капель 30 % раствора пероксида водорода и прокипятить. К полученному желтому раствору хромата добавить по каплям раствор серной кислоты до перехода окраски в оранжевую (образование дихромата). Добавить 5-6 капель 30 % пероксида водорода, 5-6 капель амилового спирта и избыточное количество раствора 20 % серной кислоты. После интенсивного перемешивания верхний слой амилового спирта окрасится в синий цвет. 11. Катион Al3+ - в водных растворах бесцветен. Характерным и очень чувствительным реактивом обнаружения алюминия является алюминон (ауринтрикарбонат аммония) - сложное органическое соединение, образующее с Al3+ труднорастворимую соль красного цвета:
Реакция протекает только при pH = 5 в среде ацетатного буферного раствора (смесь растворов CH3COOH и CH3COONa в соотношении 1:2), т.к. в ходе реакции алюминий замещает однозарядный катион аммония в виде гидроксокомплекса [Al(OH)2]+, существующем при рН = 5. При проведении реакции следует учитывать, что алюминон сам окрашен в красный цвет и его расход на реакцию должен быть очень небольшим. Ход анализа. К 2 мл исходного раствора соли алюминия добавить по каплям уксусную кислоту и ацетат натрия в соотношении 1:2. Перемешать и проверить рН. Точно значение рН = 5 устанавливают добавлением уксусной кислоты (при рН>5) или ацетата натрия (при рН<5). Затем добавить 1-2 капли 0,01 % раствора алюминона - образуется красный осадок. Появляющаяся красно-розовая окраска при нагревании усиливается.
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 449; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.37.129 (0.006 с.) |

 .
.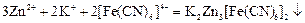 .
. .
. , окрашены в желтый цвет, а в более кислых средах, представленные дихроматами
, окрашены в желтый цвет, а в более кислых средах, представленные дихроматами  , имеют оранжевую окраску. Определение Cr (III) основано на предварительном его окислении пероксидом водорода в щелочной среде до хроматов:
, имеют оранжевую окраску. Определение Cr (III) основано на предварительном его окислении пероксидом водорода в щелочной среде до хроматов: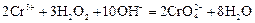
 ,
, .
. .
. и т.д.
и т.д. .
.



