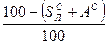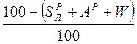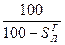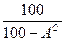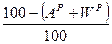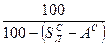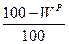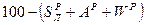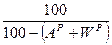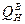Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет процесса горения топлива в греющей камереСодержание книги
Поиск на нашем сайте
Температура сгорания топлива определяется из уравнения теплового баланса реакции горения, имеющего в общей форме вид:
где Уравнение (5.9) решается обычно итерационным методом, то есть задаются каким-либо значением Энтальпия уходящих газов (
где Суммарная теплоемкость продуктов горения определяется уравнением:
где В состав жидких и твердых топлив входят горючие элементы и негорючие примеси (балласт). К горючим относятся углерод (C), водород (H) и горючая (летучая) сера (S Л). Часть серы образует в топливе сложные соединения с внутренним балластом (кислородом и азотом) и не участвует в реакции горения. Кроме того, в топливе присутствует внешние примеси: зола (А) и влага (W). Поэтому для топлив различают органическую, горючую, сухую и рабочую массу топлив. Органическая масса включает в себя углерод, водород, кислород и азот (соответствующий массовый состав обозначают Зная состав горючего, можно теоретически определить теплоту его сгорания. Для твердых и жидких топлив при этом используется формула Д.И. Менделеева:
Для газообразных горючих расчет проводится по составу сухого горючего. Теплота сгорания может быть приближенно определена как сумма произведений теплот сгорания отдельных горючих газов (уменьшенных в 100 раз) на объемное содержание этих газов в смеси, выраженное в процентах:
Для газов характерных газовых месторождений эти данные сведены в таблицы (см. например, табл. 3, 7). Табл. 8 Соотношения между различными способами представления состава горючего
Для известного состава горючего легко рассчитывается и количество кислорода или воздуха, теоретически необходимого для обеспечения полного сгорания горючего. Расчет проводится с использованием стехиометрических уравнений, описывающих процессы горения отдельных компонентов газовой смеси, представленных в табл. 9. Табл. 9 Характеристики основных реакций, протекающих при горении газообразного топлива
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 141; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.35.116 (0.006 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

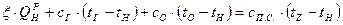 , (5.9)
, (5.9)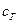 ,
, 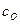 и
и  – теплоемкости соответственно горючего, окислителя и продуктов сгорания;
– теплоемкости соответственно горючего, окислителя и продуктов сгорания;  ,
, 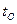 ,
, 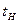 и
и  – температуры соответственно горючего, окислителя, начальная (принята одинаковой для окислителя и горючего) и температура горения топлива.
– температуры соответственно горючего, окислителя, начальная (принята одинаковой для окислителя и горючего) и температура горения топлива.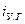 ) равна:
) равна: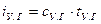 , (5.10)
, (5.10)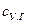 и
и 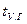 – соответственно средняя теплоемкость и температура уходящих газов.
– соответственно средняя теплоемкость и температура уходящих газов. , (5.11)
, (5.11)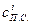 и
и  – теплоемкости при температуре горения и объемные доли составляющих продуктов горения, n – число продуктов, индекс i характеризует конкретный продукт.
– теплоемкости при температуре горения и объемные доли составляющих продуктов горения, n – число продуктов, индекс i характеризует конкретный продукт.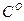 ,
, 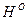 ,
,  и
и 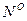 ). Горючая масса в дополнение к органической включает горючую серу (соответствующий состав обозначают
). Горючая масса в дополнение к органической включает горючую серу (соответствующий состав обозначают  ,
, 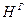 ,
,  ,
, 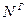 и
и 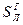 ). Сухая масса помимо горючей включает в себя золу (состав обозначают как
). Сухая масса помимо горючей включает в себя золу (состав обозначают как  ,
, 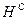 ,
, 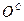 ,
, 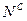 ,
,  и
и 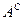 ). Рабочая масса характеризует полный состав горючего (
). Рабочая масса характеризует полный состав горючего (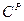 ,
,  ,
, 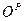 ,
,  ,
, 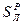 ,
, 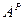 и
и 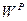 ). Соотношения между рассматриваемыми составами сведены в табл. 8.
). Соотношения между рассматриваемыми составами сведены в табл. 8.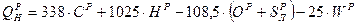 (5.12)
(5.12)
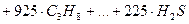 (5.13)
(5.13)