Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Проведения вакцинации взрослого населенияСтр 1 из 10Следующая ⇒
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПОРЯДОК ПРОВЕДЕНИЯ ВАКЦИНАЦИИ ВЗРОСЛОГО НАСЕЛЕНИЯ ПРОТИВ COVID-19 Москва 2021
ОГЛАВЛЕНИЕ
Настоящие методические рекомендации разработаны Федеральным дистанционным консультативным центром по вопросам вакцинации против новой коронавирусной инфекции COVID-19 (Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр терапии и профилактической медицины» Министерства здравоохранения Российской Федерации) совместно с Федеральной службой по надзору в сфере здравоохранения, Государственной корпорацией по атомной энергии «Росатом».
1.1. Настоящие Методические рекомендации содержат требования к проведению вакцинации против COVID-19 взрослого населения. 1.2. Требования, изложенные в Методических рекомендациях, направлены на обеспечение эффективности и безопасности вакцинации против COVID-19 взрослого населения, а также обеспечение достоверности учета проведенной вакцинации против COVID-19 взрослого населения. 1.3. Методические рекомендации предназначены для специалистов организаций здравоохранения, независимо от организационно-правовых форм и форм собственности, осуществляющих деятельность в области «вакцинации (проведение профилактических прививок)» в установленном порядке.
Фармаконадзор 8.1. В соответствии с приказом Росздравнадзора от 15.02.2017 № 1071 «Об утверждении порядка осуществления фармаконадзора» в медицинской организации должен быть организован фармаконадзор лекарственных препаратов. 8.2. При работе с побочными проявлениями после иммунизации вакцин следует учитывать положения «Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации» (утверждены Минздравом России 12.04.2019). 8.3. При установлении факта развития любого ПППИ в процессе активного наблюдения за привитыми в поствакцинальном периоде или при обращении за медицинской помощью сведения обо всех случаях побочных проявлений после иммунизации (ПППИ) врачом (фельдшером) вносятся в медицинскую документацию: карту амбулаторного больного (ф. 025-87), сертификат профилактических прививок (ф. 156/у-93), журнал учета профилактических прививок (ф. 064у). 8.4. При развитии серьезных ПППИ, подлежащих расследованию, кроме вышеуказанных документов сведения вносятся в журнал учета инфекционных заболеваний (ф. 060у), при госпитализации больного - в карту вызова скорой помощи (ф.110/у) и медицинскую карту стационарного больного (ф. 003-1/у).
8.5. В случае развития серьезных ПППИ (ПВО), подлежащих расследованию, непредвиденных ПППИ, либо кластера случаев ПППИ врач (фельдшер) обязан: - оказать больному медицинскую помощь, при необходимости обеспечить своевременную госпитализацию в стационар, где может быть оказана специализированная медицинская помощь; - незамедлительно информировать руководителя медицинской организации о возникновении (подозрении) серьезных ПППИ (ПВО), непредвиденных ПППИ, либо кластера ПППИ. 8.6. Руководитель медицинской организации при возникновении (подозрении) серьезных ПППИ (ПВО), подлежащих расследованию, а также случаев ПППИ, потребовавших госпитализации, непредвиденных ПППИ, либо кластера ПППИ: - в течение 2 часов с момента их выявления информирует устно(ФИО пациента, дату рождения, дату вакцинации, характер ППИ, принятые меры), по телефону территориальный орган управления здравоохранением и территориальный орган Роспотребнадзора, уполномоченный осуществлять федеральный государственный санитарно-эпидемиологический надзор по месту их выявления; организует первичное расследование причин ПППИ (ПВО) с участием иммунологической комиссии медицинской организации; - временно приостанавливает использование рекламационной серии ИЛП в медицинской организации; - в течение 12 часов с момента их выявления – обеспечивает представление в письменной форме (или по каналам электронной связи) экстренного извещения о регистрации случая серьезного ПППИ (ПВО), непредвиденных ПППИ, либо кластера ПППИ: - в территориальный орган (учреждение) Роспотребнадзора, уполномоченный осуществлять федеральный государственный санитарно-эпидемиологический надзор по месту их выявления (в соответствии с Постановлением Главного государственного санитарного врача Российской Федерации от 04.02.2016 № 11 «О представлении внеочередных донесений о чрезвычайных ситуациях санитарно-эпидемиологического характера»); - в подсистему «Фармаконадзор» Автоматизированной информационной системы Росздравнадзора (АИС Росздравнадзора). 8.7. Каждое побочное проявление после иммунизации, относимое Методическими рекомендациями по выявлению, расследованию и профилактике побочных проявлений после иммунизации к категории серьезных подлежит расследованию иммунологической комиссией медицинской организацией, осуществляющей иммунизацию. 8.8. Для вакцин, к побочным проявлениям после иммунизации относятся все, потребовавшие госпитализации, либо закончившиеся летально, а также следующие осложнения: ● Абсцесс, флегмона в месте введения ● Анафилактический шок/анафилактоидная реакция ● Коллапс/коллаптоидная реакция ● Генерализованная сыпь, полиморфная экссудативная эритема, отек Квинке, синдром Лайелла, др. формы тяжелых аллергических реакций ● Энцефалическая реакция (энцефалопатия) ● Синдром Гийена-Барре ● Судороги/ судорожный синдром ● Острый миокардит, острый нефрит, тромбоцитопеническая пурпура, агранулоцитоз, гипопластическая анемия, системные заболевания соединительной ткани, хронический артрит
● Внезапная смерть, другие случаи летальных исходов, имеющие временную связь с прививками 8.9. Расследование каждого случая ПППИ (ПВО) (или подозрения), потребовавшего госпитализации, а также завершившегося летальным исходом должно быть проведено комиссионно с участием компетентных специалистов (педиатров, терапевтов, иммунологов, фтизиатров, эпидемиологов и др.), назначаемых руководителем органа исполнительной власти субъекта Российской Федерации в сфере охраны здоровья, специалистов органов, осуществляющих надзор в сфере защиты прав потребителей и благополучия человека (Роспотребнадзора) и в сфере здравоохранения и обращения лекарственных средств (Росздравнадзора). 8.10. В субъектах Российской Федерации предпочтительно создать и утвердить региональные иммунологические комиссии (далее - Комиссия), которые могут быть оперативно привлечены для проведения комиссионного расследования ПППИ (ПВО). 8.11. При расследовании и составлении акта используют форму акта расследования (приложение 1 «Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации», утвержденных Минздравом России 12.04.2019), а также руководствуются сроками развития различных форм поствакцинальной патологии (таблица 6 указанных методических рекомендации). 8.12. При возникновении затруднений при установлении окончательного диагноза и возможной причинно-следственной связи с вакцинацией на уровне субъекта Российской Федерации рекомендовано обращаться за методической поддержкой к главным внештатным специалистам Минздрава России (инфекционисту, эпидемиологу, иммунологу-аллергологу, специалисту по профилактической медицине и других необходимых экспертов) для формирования окончательного заключения. 8.13. Акт расследования каждого случая серьезного ПППИ (ПВО) после применения ИЛП, как потребовавшего, так и не потребовавшего госпитализации (в последнем случае с копией истории болезни) Комиссией направляется в направляются в Центральный аппарат Росздравнадзора (предпочтительно в электронной форме в качестве приложения к извещению о нежелательной реакции на лекарственный препарат информационного ресурса «Фармаконадзора 2.0» Автоматизированной Информационной Системы Росздравнадзора), Управление Роспотребнадзора по субъекту Российской Федерации и региональную иммунологическую комиссию субъекта Российской Федерации.
8.14. Информация о расследовании с соблюдением законодательства Российской Федерации о медицинской тайне и персональных данных также направляется производителю ИЛП в целях обеспечения реализации держателями регистрационных удостоверений лекарственных препаратов законодательных требований по фармаконадзору, установленных Федеральным законом от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». Использованные источники ✓ Федеральный закон от 17.07.1998 № 157-ФЗ «Об иммунопрофилактике инфекционных болезней»; ✓ Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации»; ✓ Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств»; ✓ Постановление Правительства Российской Федерации от 01.06.2021 № 852 «О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково») и признании утратившими силу некоторых актов Правительства Российской Федерации»; ✓ Приказ Министерства здравоохранения и социального развития Российской Федерации от 15.05.2012 № 543 «Об утверждении Положения об организации оказания первичной медико-санитарной помощи взрослому населению»; ✓ Постановление Правительства Российской Федерации от 31.03.2020 №373 «Об утверждении Временных правил учета информации в целях предотвращения распространения новой коронавирусной инфекции (COVID-19)»; ✓ Постановление Главного государственного санитарного врача Российской Федерации от 03.03.2008 № 15 «Об утверждении санитарно-эпидемиологических правил СП 3.3.2342-08» (вместе с «СП 3.3.2342-08. Обеспечение безопасности иммунизации. Санитарно-эпидемиологические правила»); ✓ Постановление Главного государственного санитарного врача Российской Федерации от 17.02.2016 № 19 «Об утверждении санитарно-эпидемиологических правил СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов»; ✓ Постановление Главного государственного санитарного врача Российской Федерации от 04.06.2008 № 34 «Об утверждении санитарно-эпидемиологических правил СП 3.3.2367-08» (вместе с «СП 3.3.2367-08. Организация иммунопрофилактики инфекционных болезней. Санитарно-эпидемиологические правила»); ✓ Постановление Главного государственного санитарного врача Российской Федерации от 3.12.2020 № 41 «Об утверждении санитарно-эпидемиологических правил СП 3.1.3671-20 «Условия транспортирования и хранения вакцины для профилактики новой коронавирусной инфекции (COVID-19) Гам-Ковид-Вак»; ✓ Постановление Правительства Российской Федерации от 03.04.2020 №440 «О продлении действия разрешений и иных особенностях в отношении разрешительной деятельности в 2020 году»; ✓ Распоряжение субъекта об организации выездной/мобильной вакцинации;
✓ «Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации», утвержденные Министерством здравоохранения Российской Федерации от 12.04.2019; ✓ Приказ Федеральной службы по надзору в сфере здравоохранения от 15.02.2017 № 1071 «Об утверждении порядка осуществления фармаконадзора»; ✓ Приказ Минздрава России от 21.03.2014 № 125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям»; ✓ Приказ Министерства здравоохранения Российской Федерации от 3.02.2021 № 47н «О внесении изменения в календарь профилактических прививок по эпидемическим показаниям, утвержденный приказом Министерства здравоохранения Российской Федерации от 21 марта 2014 № 125н». 13. Термины, определения, сокращения и условные обозначения
Приложение № 1
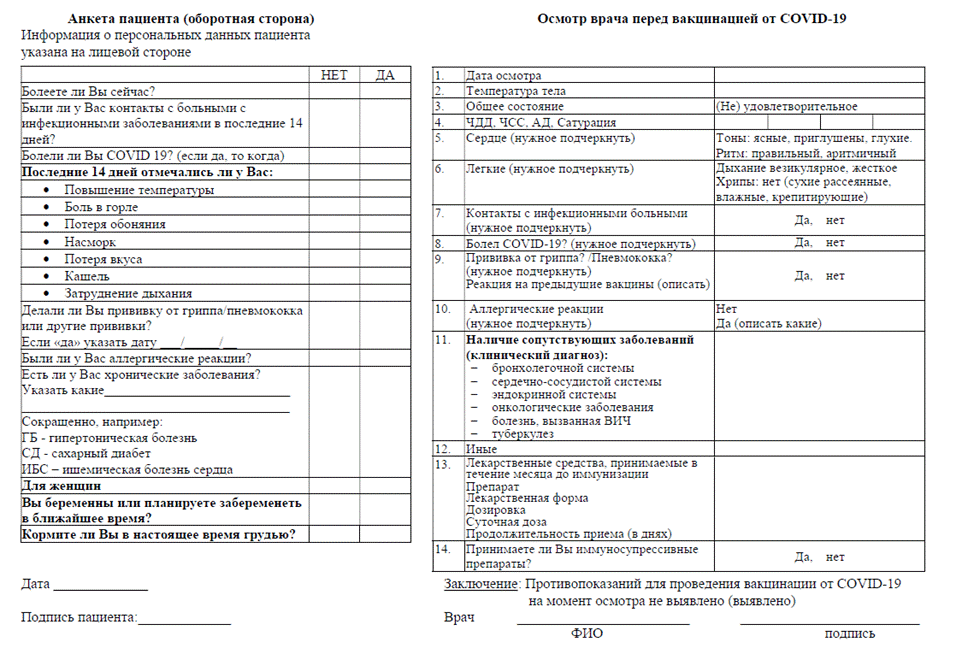
Приложение № 2 Памятка пациента о проведении вакцинации против COVID-19 _____________________________________________________________________________ (наименование вакцины)
Уважаемый пациент!
Ваше крепкое здоровье - наша главная цель! А для того, чтобы полностью реализовать наш потенциал в достижении главной цели, мы просим Вас соблюдать некоторые (основные и важные) правила, которые помогут нам в нашей работе: 1. Перед проведением вакцинации необходим обязательный осмотр врача с измерением температуры, сбором эпидемиологического анамнеза, измерением сатурации, осмотром зева, на основании которых врач определяет отсутствие или наличие противопоказаний к вакцинации. Врач расскажет Вам о возможных реакциях на вакцинацию и поможет заполнить информированное добровольное согласие на проведение вакцинации. 2. Вакцинацию проводят в два этапа: вначале вводят компонент I в дозе 0,5 мл. Препарат вводят внутримышечно. На ______ день вводят компонент II в дозе 0,5 мл[5]∗. Препарат вводят внутримышечно. I этап вакцинации (число, месяц, год) _________________________ II этап вакцинации* (число, месяц, год) ________________________ 3. В течение 30 мин после вакцинации просим Вас оставаться в медицинской организации для предупреждения возможных аллергических реакций. 4. После проведения вакцинации (и после введения I компонента и после введения II компонента*) в первые - вторые сутки могут развиваться и разрешаются в течение трех последующих дней кратковременные общие (непродолжительный гриппоподобный синдром, характеризующийся ознобом, повышением температуры тела, артралгией, миалгией, астенией, общим недомоганием, головной болью) и местные (болезненность в месте инъекции, гиперемия, отечность) реакции. Реже отмечаются тошнота, диспепсия, снижение аппетита, иногда - увеличение регионарных лимфоузлов. Возможно развитие аллергических реакций. 5. Рекомендуется в течение 3-х дней после вакцинации не мочить место инъекции, не посещать сауну, баню, не принимать алкоголь, избегать чрезмерных физических нагрузок. При покраснении, отечности, болезненности места вакцинации принять антигистаминные средства. При повышении температуры тела после вакцинации - нестероидные противовоспалительные средства. 6. Курс иммунизации считается завершенным после проведения двух этапов вакцинации. Приложение № 3 Приложение № 4 Приложение № 5
Приложение № 5
Приложение № 5
Приложение № 6 Примеры решений по оптимизации
Приложение № 6 Примеры решений по оптимизации
Приложение № 6 Примеры решений по оптимизации
Приложение № 7 Примеры организации Приложение № 8 Авторский коллектив Драпкина Оксана Михайловна – главный внештатный специалист по терапии и общей врачебной профилактике, директор ФГБУ «НМИЦ ТПМ» Минздрава России Камкин Евгений Геннадьевич – заместитель Министра здравоохранения Российской Федерации Глаголев Сергей Владимирович –заместительМинистраздравоохранения Российской Федерации Самойлова Алла Владимировна – руководитель Федеральной службы по надзору в сфере здравоохранения Российской Федерации Якимова Юлия Викторовна – заместитель главного врача по общим вопросам ФГБУ «НМИЦ ТПМ» Минздрава России Горшков Александр Юрьевич – заместитель главного врача по организационно-методической работе ФГБУ «НМИЦ ТПМ» Минздрава России Обозов Сергей Александрович - заместитель генерального директора по развитию производственной системы Госкорпорации «Росатом» Грабельников Константин Владимирович – директор проекта проектного офиса по программе развития производственных систем в отрасли Госкорпорация «Росатом» Штригель Иван Юрьевич – руководитель проекта проектного офиса по программе развития производственных систем в отрасли Госкорпорация «Росатом» Прохоренков Кирилл Викторович – руководитель проекта АО «ПСР»
[1] Постановление Главного государственного санитарного врача Российской Федерации от 3.12. 2020г. № 41 «Об утверждении санитарно-эпидемиологических правил СП 3.1.3671-20 «Условия транспортирования и хранения вакцины для профилактики новой коронавирусной инфекции (COVID-19) «Гам-Ковид-Вак»). [2] Вакцинация вторым компонентом проводится: «Гам-КОВИД-Вак», «Гам-КОВИД-Вак-Лио» через 3 недели после I этапа, «ЭпиВакКорона» с интервалом не менее 14-21 день после I этапа; «КовиВак» проводится с интервалом 2 недели после I этапа; вакцинация препаратом «Спутник Лайт» проводится одним компонентом, однократно.
[3] Постановление Главного государственного санитарного врача Российской Федерации от 17.02.2016 № 19 «Об утверждении санитарно-эпидемиологических правил СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов». [4] Постановление Главного государственного санитарного врача Российской Федерации от 17.02.2016 № 19 «Об утверждении санитарно-эпидемиологических правил СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов».
[5]∗ Вакцинация препаратом «Спутник Лайт» проводится одним компонентом, однократно.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПОРЯДОК ПРОВЕДЕНИЯ ВАКЦИНАЦИИ ВЗРОСЛОГО НАСЕЛЕНИЯ ПРОТИВ COVID-19 Москва 2021
ОГЛАВЛЕНИЕ
Настоящие методические рекомендации разработаны Федеральным дистанционным консультативным центром по вопросам вакцинации против новой коронавирусной инфекции COVID-19 (Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр терапии и профилактической медицины» Министерства здравоохранения Российской Федерации) совместно с Федеральной службой по надзору в сфере здравоохранения, Государственной корпорацией по атомной энергии «Росатом».
1.1. Настоящие Методические рекомендации содержат требования к проведению вакцинации против COVID-19 взрослого населения. 1.2. Требования, изложенные в Методических рекомендациях, направлены на обеспечение эффективности и безопасности вакцинации против COVID-19 взрослого населения, а также обеспечение достоверности учета проведенной вакцинации против COVID-19 взрослого населения. 1.3. Методические рекомендации предназначены для специалистов организаций здравоохранения, независимо от организационно-правовых форм и форм собственности, осуществляющих деятельность в области «вакцинации (проведение профилактических прививок)» в установленном порядке.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 70; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.47.221 (0.093 с.) |