
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Устойчивость растворов биополимеров. Высаливание биополимеров из раствора. Коацервация и её роль в биологических системах.Содержание книги
Поиск на нашем сайте
1) Понятие о полимерах медицинского (стоматологического) назначения Специальные П. м. медицинского назначения предназначены для непосредственного контакта с живым организмом — в эндопротезах и материалах для восстановительной хирургии, в материалах и изделиях для службы крови, в виде инструментов для внутриорганных исследований, аппаратуры, заменяющей функции сдельных органов, компонентов терапевтических и диагностических средств. Биоинертные П. м. (полиэтилен, полипропилен, фторопласт, силиконы, полиметилметакрилат и др.) практически не изменяют своих свойств под влиянием сред живого организма. В виде готовых изделий или материалов их используют для создания искусственных сосудов (полиэтилентерефталат, полипропилен, фторопласт), клапанов сердца (силикон, фторопласт, полипропилен, полиэтилентерефталат), хрусталиков глаз (полиметилметакрилат), частей эндопротезов суставов (полиамиды, фторопласт), в качестве искусственных сухожилий, мышечных связок (полипропилен, полиэтилентерефталат), деталей аппаратов искусственная почка, искусственное сердце — легкое (полиэтилен, полипропилен, полиакрилаты, силиконы, эфиры целлюлозы) и др.
— Полимеры (термин введен в 1883 г. Й. Я. Берцелиусом) — основа пластмасс, химических волокон, резины, лакокрасочных материалов, клеев.
Крч в стоматологии из них протезы делают и всякую фигню для укрепления и эстетики зубов. 2) Свойства растворов ВМС
3) Особенности растворения ВМС как следствие их структуры. Термодинамика растворения ВМС. С термодинамической точки зрения растворение полимера, как любой самопроизвольный процесс, должен протекать с уменьшением свободной энергии системы (DG < 0). Поскольку DG = DН – TDS, то уменьшению свободной энергии способствуют следующие два условия: DН < 0 (уменьшение энтальпийного фактора) и DS > 0 (увеличение энтропийного фактора). Растворение полярного полимера в полярном растворителе (неполярного – в неполярном) чаще всего сопровождается уменьшением внутренней энергии системы, так как растворение идет с выделением теплоты (DН < 0) вследствие гидратации (сольватации) макромолекул полимера. Энтропия растворения высокомолекулярных веществ всегда во много раз выше энтропии растворения низкомолекулярных веществ. Это объясняется характерными особенностями химического строения макромолекул полимеров. Длинные гибкие макромолекулы могут принимать в растворе множествоконформаций, которые мало различаются между собой по внутренней энергии. Известно, что состояние системы, которого можно добиться бóльшим числом микросостояний, обладает бóльшей термодинамической вероятностью W и, следовательно, характеризуется согласно уравнению S=klnW более высокой энтропией. Поскольку в растворе число возможных конформаций гибких макромолекул гораздо больше, чем в твердом полимере, то растворение полимера сопровождается значительным увеличением энтропии. Энтропийный фактор особенно важен для неполярных полимеров с гибкими молекулами (каучук, поливинилацетат). Для таких полимеров увеличение энтропии обеспечивает соблюдение условия DG < 0 даже при увеличении энтальпийного фактора (DН > 0). В макромолекулах полярных ВМС, обычно обладающих жесткими цепями (поливиниловый спирт, белки), число возможных конформаций в растворе уменьшается, вследствие чего для этих полимеров возрастает значениеэнтальпийного фактора, т.е гидратация макромолекул. Из выше сказанного следует, что образование растворов ВМС сопровождается уменьшением свободной энергии Гиббса. Следовательно, процесс растворения в данном случае идёт самопроизвольно и образующийся раствор будет термодинамически устойчив.
3) Форма макромолекул
глобулярные (globulus - шар) – это полимеры, молекулы которых завиты в сферические клубки – глобулы. (например растворимые в воде белки, гемоглобин крови, фермент желудочного сока пепсин) фибриллярные (fibrilla- волокно) – это полимеры макромолекулы которых имеют линейные или слаборазветвленные цепи (например миозин-белок мышц, кератин – белок волос, коллаген и эластин – белок кожи)
4) Механизм набухания и растворения ВМС. Зависимость величины набухания от различных факторов.
α = m- m0/ m0 или α = V- V0/ V0
Температура
РН среды.
5. Электролиты.
SCN->I->Br->NO3-> Cl->CH3COO->ClO4->SO42- Увеличивают не влияют уменьшают набухание на набухание набухание Степень подробленности.
5) Аномальная вязкость растворов ВМС. Уравнение Штаудингера. Вязкость крови и других биологических жидкостей. Вязкостью или внутренним трением называют меру сопротивления среды движению. Измерение вязкости - самый простой и доступный способ изучения свойств макромолекул. Он ценен тем, что позволяет определять молекулярную массу биополимеров. Коэффициент динамической вязкости или абсолютной вязкости количественно характеризует сопротивление жидкости смещению ее слоев. Вязкость раствора выражают несколькими величинами: удельная вязкость, приведенная вязкость, характеристическая вязкость. Относительная вязкость является мерой изменения вязкости раствора по сравнению с вязкостью чистого растворителя. Удельная вязкость отражает возрастание относительной вязкости по сравнению с единицей. Чтобы учесть влияние концентрации раствора, т.е. оценить, насколько велика удельная вязкость, отнесенная к единице концентрации растворенного вещества. В растворах высокомолекулярных веществ обнаруживается аномальная вязкость: она очень высока и в противоположность первой группе жидкостей уменьшается с увеличением давления на протекающую жидкость. Большая вязкость этих растворов зависит от степени сродства между молекулами: силы сцепления гидрофильных молекул белков и полисахаридов с молекулами воды очень высоки, и вязкость их даже в очень разбавленных растворах также будет высокой. Кроме того, большое значение имеет форма частиц, Если вытянутые частицы располагаются поперек потока, то они оказывают наибольшее сопротивление. При увеличении внешнего давления на жидкость эти частицы ориентируются вдоль потока, в результате вязкость раствора уменьшается. Уравнение Штаудингера справедливо только для растворов полимеров с короткими и жесткими цепями, которые могут сохранять палочкообразную форму. Гибкие молекулы полимеров, имеющие длинные цепи, обычно свертываются в клубок, что уменьшает сопротивление их движению. При этом константа К изменяется и зависимость вязкости от молекулярной массы оказывается нелинейной.
Взаимодействие фосфазенов с карбонильными соединениями используется как метод синтеза иминов (иминирование по Штаудингеру):
Вязкость крови – это соотношение числа форменных элементов крови и объема ее жидкой части (плазмы). Это невероятно важный показатель состояния крови. Он определяет максимальный срок нормальной работы кровеносной системы, ведь чем выше вязкость, тем быстрее «изнашивается» сердце. 6) Осмотическое давление растворов биополимеров. Уравнение Галлера. Полиэлектролиты.
Осмотическое давление в растворах ВМС нелинейно зависит от концентрации (см. график Росм = f (СВМС)).
Росм = СRT / M + bc2 (уравнение Галлера) М - молярная масса, С – весовая концентрация ВМС (г/л), b - величина, зависящая от природы растворителя. С помощью этого уравнения на практике определяют молярную массу (М) полимера. Осмотическое давление в биологических жидкостях обусловлено наличием как низкомолекулярных соединений (электролитов и неэлектролитов), так и высокомолекулярных соединений - главным образом, белков. Осмотическое давление крови, которое обусловлено наличием высокомолекулярных соединений, называется онкотическим, его величина составляет ≈0,04 атм. Общее осмотическое давление крови 7,7 ± 8,1 атм. Полиэлектролит — полимер, в состав молекул которого входят группы, способные к ионизации в растворе. Полиэлектролиты применяются в технике в качествекоагулянтов для очистки сточных вод, в качестве диспергаторов для снижения вязкости высококонцентрированных дисперсных систем на водной основе (суспензии ипасты в производстве керамики). Эффективность полиэлектролитов в этих приложениях объясняется адсорбцией полиионов на поверхность частиц с формированиемдвойного электрического слоя, эффективно снижающего трение между частицами. К полиэлектролитам относятся важнейшие биологические полимеры (биополимеры) — белки, нуклеиновые кислоты. Они играют важную роль в регулировании вязкости крови. Большое практическое значение имеют иониты. 7) Изоэлектрическая точка и методы её определения На примере белка я нашла, суть понятна
Изоэлектрической точкой белка называется определенная величина рН среды, при которой белок находится в виде нейтральных молекул (в изоэлектрическом состоянии), несущих равные количества положительных и отрицательных зарядов. При других концентрациях ионов водорода в растворе имеются преимущественно положительные и отрицательные ионы белка. Растворы белков в изоэлектрической точке наименее устойчивы и легко выпадают в осадок. Для большинства белков изоэлектрическая точка близка к нейтральной среде, но не вполне совпадает с ней, для многих белков она сдвинута в кислую сторону, а некоторые белки имеют изоэлектрическую точку при слабощелочной реакции среды. Определение изоэлектрической точки может быть сведено к определению рН раствора, при котором наблюдается наиболее быстрое и полное выпадение белка в осадок. 8) Онкотическое давление плазмы и сыворотки крови. в составе плазмы - белки, которые выполняют функции: 2. Белки плазмы принимают активное участие в свертывании крови. 3. Белки плазмы в известной мере определяют вязкость крови, 5. Важна также транспортная функция белков плазмы крови: соединяясь с рядом веществ (холестерин, билирубин и др.), а также с лекарственными средствами (пенициллин, салицилаты и др.), они переносят их к тканям. 6. Белки плазмы играют важную роль в процессах иммунитета (особенно это касается иммуноглобулинов). 7. В результате образования с белками плазмы недиализируемых комплексов поддерживается уровень катионов в крови. Например, 40–50% кальция сыворотки связано с белками, значительная часть железа, магния, меди и других элементов также связана с белками сыворотки. 8. Наконец, белки плазмы крови могут служить резервом аминокислот. Современные физико-химические методы позволили открыть и описать около 100 различных белковых компонентов плазмы крови. Особое значение приобрело электрофоретическое разделение белков плазмы (сыворотки) крови. Онкотическое давление является частью осмотического и зависит от содержания крупномолекулярных соединений (белков) в растворе.Хотя концентрация белков в плазме довольно велика, общее количество молекул из-за их большой молекулярной массы относительно мало, благодаря чему онкотическое давление не превышает 30 мм рт.ст. Онкотическое давление в большей степени зависит от альбуминов (80% онкотического давления создают альбумины), что связано с их относительно малой молекулярной массой и большим количеством молекул в плазме. Онкотическое давление играет важную роль в регуляции водного обмена. Чем больше его величина, тем больше воды удерживается в сосудистом русле и тем меньше ее переходит в ткани и наоборот. Онкотическое давление влияет на образование тканевой жидкости, лимфы, мочи и всасывание воды в кишечнике. При снижении концентрации белка в плазме развиваются отеки, так как вода перестает удерживаться в сосудистом русле и переходит в ткани. 9) Устойчивость растворов биополимеров. Высаливание биополимеров из раствора. Коацервация и её роль в биологических системах. Растворы ВМС – устойчивые системы, однако при определенных условиях возможно нарушение устойчивости, что приводит к высаливанию, коацервации, застудневанию. Высаливание ВМС. Растворы ВМС образуются самопроизвольно и являются термодинамически устойчивыми. Под влиянием электролитов происходит процесс выделения ВМС из раствора, называемый высаливанием. Для разрушения раствора ВМС требуется большая концентрация электролита. В основе механизма высаливания ВМС лежит процесс дегидратации. Ионы введенного электролита и молекулы спирта как бы «отнимают» большую часть растворителя от макромолекулы полимера. Концентрацию электролита, при которой наступает быстрое осаждение полимера, называют порогом высаливания ВМС. Высаливающее действие ионов изменяется в соответствии с их гидратируемостью. Высаливание ВМС имеет большое практическое значение. Его применяют для фракционирования белков, полисахаридов и других веществ. В фармацевтической технологии высаливание часто применяют в производстве ферментных и других препаратов из животного сырья с целью осаждения примесей сопутствующих белков или для выделения действующего белка (гормона, фермента). В аптечной технологии лекарств высаливающее действие электролитов (а также этилового спирта, сахарного сиропа), учитывают при изготовлении растворов ВМС. Этиловый спирт и большие количества электролитов несовместимы с раствором ВМС. Коацервация. При нарушении устойчивости раствора ВМС возможно образование коацервата – новой жидкой фазы, обогащенной полимером. Это явление носит название коацервации и характерно для ряда белков. Оно заключается в разложении системы на две фазы, из которых одна представляет собой раствор ВМС в растворителе, а другая – раствор растворителя в ВМС. Коацерват может находиться в исходном растворе в виде капель или образовывать сплошной слой (расслаивание). Процессу коацервации способствует низкая температура, изменения рН среды, введение низкомолекулярных электролитов. Наиболее изучена коацервация белков и полисахаров в водных растворах. Коацервацию используют при микрокапсулировании лекарств. Застудневание. В результате ограниченного набухания ВМС или частичного испарения растворителя из раствора ВМС образуются студни. Таким образом, студень можно рассматривать как ограниченно набухший полимер или концентрированный раствор полимера. Студни – это гомогенные системы. При старении гомогенность студней нарушается вследствие синерезиса – постепенного сжатия полимерной сетки (матрицы) и выделения жидкой фазы. Синерезиз сопровождается уплотнением пространственной структуры-сетки и уменьшением объема студня. Пример синерезиса – отделение сыворотки при свертывании крови. Явление студнеобразования широко применяется при создании лекарственных препаратов – мазей и суппозиториев на соответствующих основах, депо лекарственных веществ, сорбентов, мембран с регулируемой скоростью высвобождения. Студни используют в процессе гельпроникающей хроматографии при разделении на группы суммарных (например, экстракционных) препаратов, а также для получения обессоленных препаратов, в том числе обессоленной воды. Таким образом, разнообразные специфические свойства природных и синтетических полимеров широко используются в фармацевтической технологии. Применение их идет по разным направлениям. Гели и студни - связанно-дисперсные системы.Классификация гелей. Характеристика хрупких и эластичных гелей. Способы получения гелей. Процесс желатинирования. Факторы, способствующие желатинированию. Застудневание. Факторы, влияющие на процесс застудневания. Набухание ксерогелей. Факторы, от которых зависит процесс набухания. Явления, сопровождающие процесс набухания. 1) Растворы высокомолекулярных соединений и золи многих гидрофобных коллоидов при определенных условиях могут терять текучесть, превращаясь на студни и гели. Гелями называют системы, которые потеряли текучесть за счет образования внутренних структур.
Неограниченное набухание → раствор ВМС (гомогенная система) Ограниченное набухание → гель; Высокомолекулярные вещества, набухая, образуют эластичные студни, а в их растворах могут развиваться структурные сетки, приводящие к отвердению растворов – образованию студней. Процесс гелеобразования - превращение жидкой коллоидной системы в твердообразную, причем дисперсная фаза и дисперсионная среда не разделяются. Способы получения гелей 1. Желатинирование (золь → гель) 2. Застудневание (раствор ВМС → эластический студень) 3. Ограниченное набухание (полимер → эластический студень)
Набухание- -процесс проникновения растворителя в полимерное вещество, сопровождаемый увеличением объема и массы. Объём набухающего студня может в десятки раз превосходить собственный объем полимера Эбониты (сильно вулканизированные резины) практически не набухают в бензоле. Желатин набухает ограниченно в холодной воде. Каучуки (резины) ограниченно набухают в бензине. Добавление горячей воды к желатину или бензола к натуральному каучуку приводит к неограниченному набуханию (растворению) этих полимеров. Застудневание Студни образуются при ограниченном набухании твердых ВМС, а также при застудневании растворов, сопровождающемся возникновением связей между макромолекулами:
На застудневание влияют концентрация ВМС в растворе, форма его макромолекул, температура, примеси других веществ, особенно электролитов. Время застудневания может колебаться от нескольких минут до недель. Застудневанию растворов ВМС всегда способствует повышение концентрации раствора. Для каждой системы при данной температуре существует некоторая концентрация, ниже которой она не застудневает. Например, для желатина при комнатной температуре предельной концентрацией является 0,7-0,9 % (мас.). Немаловажное значение имеют размер молекул ВМС и их конформация: макромолекулы, имеющие вытянутую форму, образуют студни даже в очень разбавленных растворах. Следовательно, для студнеобразования необходимы условия, при которых макромолекула не свертывается в клубок: чем более молекула выпрямлена, тем доступнее те ее части, которые могут вступать во взаимодействие. Например, агар-агар, широко применяемый в пищевой промышленности студнеобразователь, образует студень при концентрации 0,1 % (мас.). Застудневанию препятствует повышение температуры из-за уменьшения числа связей между макромолекулами и продолжительности их существования, вызванных интенсификацией теплового движения частиц. Процесс желатинирования является одним из видов коагуляции. От обычной коагуляции он отличается тем, что здесь не образуется осадка частиц коллоида, а вся масса коллоида, связывая растворитель, переходит в своеобразное полужидкое-полутвердое состояние. 2) Классификация гелей
Хрупкие гели образуются коллоидными частицами SiO2, TiO2, SnO2, Fe2O3, V2O5 и имеют сильнопористую структуру с множеством узких жестких капилляров диаметром около 20-40 Å. При впитывании жидкости объем их практически не изменяется.
Эластичные гели (студни) образуются цепными молекулами желатина, агар-агара, каучука и поглощают только те жидкости, которые сходны с ними по своему химическому составу или в которых вещество студня может существовать виде жидкого раствора. Поглощение жидкости эластичным студнем сопровождается сильным увеличением объема.
Свойства гелей и студней: электропроводность, диффузия и кристаллизация в гелях, давление набухания, контракция, тиксотропия, синерезис, ритмические реакции, иммунодиффузия в гелях. Использование гелей в физико-химических и медико-биологических исследованиях. Проявление свойств гелей в живом организме 1) Свойства 1. Электропроводность высока Растворитель в геле образует, по существу, непрерывную среду, в которой могут передвигаться ионы различных электролитов. Гель агар-агара, содержащий KCl, используется как электролитический ключ в гальванических элементах. 2. Контракция Объем набухшего геля меньше суммы объемов геля до набухания и поглощенной им жидкости. Причина - часть поглощенной жидкости связана с молекулами набухшего вещества и находится в более уплотненном (структурированном) состоянии, чем свободная жидкость. 3.
Диффузия Чем выше концентрация геля, тем меньше скорость диффузии. Причина - в концентрированном геле резко возрастает извилистость пути, который должна совершать диффундирующая частица. 5. Кристализация в гелях В студне кремниевой кислоты удалось вырастить кристаллы меди, серебра и золота величиной 3 мм! 6. Ритмические реакции Если один из продуктов реакции - нерастворимое вещество, вместо образования осадка по всему объему в студне будут наблюдаться явления периодического осаждения - кольца Лизеганга Иммунодиффузия Диффузионные качества гелей используются для электрофореза белков. Особенно чувствительными в процессе диффузии в агаровом геле получаются реакции осаждения (преципитации) при взаимодействии белковых фракций (антигенов) с соответствующими антисыворотками (антителами). Метод Оухтерлони (определение идентичности двух антигенов в агаровом геле) 8. Синерезис - необратимый процесс старения геля. Сопровождается упорядочением структуры с сохранением первоначальной формы, сжатием сетки и выделением из нее растворителя.
Гели в организме Распределение воды и ионов между соединительной тканью и клетками определяется чередованием процессов набухания и обезвоживания
Живые организмы - студни различной степени оводнения.
Тело медузы -живой студень, содержащий до 90% воды.
Роговая ткань содержит 0.2-0.6% воды.
Высушивание куска студенистого тела медузы уменьшает объем и вес в десятки раз, а объем и вес высушенного рогового вещества практически не меняются
Набухание тканей растительных и животных организмов связано с наличием в их составе клетчатки, крахмала, белков.
Количество поглощаемой воды тканями зависит от возраста: чем моложе организм, тем сильнее выражено набухание Набухание и обезвоживание коллоидов в организме связано (воспаления, образование отеков при проникновении кислых жидкостей в ткани, при ожоге кожи крапивой, при укусах насекомых)
Нарушение обмена веществ между клеткой и окружающей средой при старении приводит к синерезису (вследствие снижения проницаемости клеточных мембран и цитоплазмы)
Упругость и эластичность костей существует благодаря Кости становятся к старости более хрупкими из-за роста содержания в них твердых минеральных веществ. Маленькие дети часто падают, не причиняя себе особенного вреда.
Растительные и животные ткани содержат коллоиды не только в виде растворов, но и в студнеобразном состоянии: - протоплазма клеток - хрусталик глаза.
|
||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 1250; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.012 с.) |

 образуются самопроизвольно при простом смешивании компонентов и сопровождаются уменьшением свободной энергии Гиббса.
образуются самопроизвольно при простом смешивании компонентов и сопровождаются уменьшением свободной энергии Гиббса.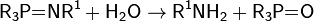
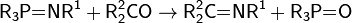
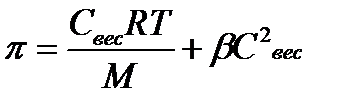 Определяется по уравнению
Определяется по уравнению Твердые ВМС Студни Растворы ВМС
Твердые ВМС Студни Растворы ВМС Тиксотропия- процесс обратимого перехода геля в золь при резком механическом воздействии.
Тиксотропия- процесс обратимого перехода геля в золь при резком механическом воздействии. 


