
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы получения коллоидных растворов (золей)
Их разделяют на диспергационные и конденсационные. Конденсационные методы. Это методы получения золей путем укрупнением микрочастиц Конденсационные методы разделяют на физические и химические. Методы физической конденсации- это конденсация пары и замена растворителя. а) метод конденсации пары. Это, например образование аэрозолей тумана, дыма. С понижением температуры давление пары несколько увеличивается чем равновесное давление над жидкостью (или твердым телом), в результате чего в газовой фазе образуются капельки жидкости (туман) или твердые частицы (дым). б) метод замены растворителя базируется на замене среды, которое происходит при прибавлении небольшого количества истинного раствора вещества к растворителю, в котором это вещество нерастворимое или малорастворимое, но оба растворителя безгранично смешиваются. Методы химической конденсации – это методы в основе которых лежат химические реакции, которые сопровождаются образованием малорастворимых веществ. Это реакции двойного обмена, восстановление, окисления, гидролиза. Чтобы получить золь нужно соблюдать такие условия: - дисперсная фаза должна быть нерастворимой в дисперсионной среде - в системе должен быть стабилизатор, который придает ей стойкости - частицы дисперсной фазы имеют коллоидную степень дисперсности. При получении золей методом химической конденсации стабилизатором есть одно из реагирующих веществ, которое взято в избытке а) Реакции двойного обмена дают возможность получить золи малорастворимых веществ: сульфатов, карбонатов, сульфидов, фосфатов многих металлов, галогенидов серебра. Диспергационные методы. Это методы дробления больших частиц до коллоидной степени дисперсности. Механическое диспергирование — это растирание, дробление веществ в специальных промышленных и лабораторных приборах – мельницах. Электрические методы диспергирования базируются на том что сквозь дисперсионную среду, например, воду, пропускают электрический ток. Электроды изготовлены с того металла, коллоидный раствор которого хотят получить. Акустические методы диспергирования базируются на использовании ультразвукового поля, тоисть колебаний большой частоты (105-106 Гц).
Физико-химическое диспергирование (пептизация). Пептизация – это дезагрегация частиц свежеполученного осадка под действием стабилизатора - пептизатора, которым есть электролит, что дает системеагрегативной стойкости.
2) Диализ, электродиализ, ультрафильтрация Диализ. Диализ является простейшим методом очистки коллоидных систем. Очистка коллоидных методом диализа заключается в том, что с помощью полупроницаемой перегородки (мембраны) коллоидные мицеллы могут быть отделены от примесей растворенных в дисперсионной среде низкомолекулярных веществ. При диализе молекулы растворенного низкомолекулярного вещества проходят через мембрану, а коллоидные частицы, неспособные диализировать (проникать через мембрану), остаются за ней в виде очищенного коллоидного раствора. Явление диализа для коллоидных систем возможно благодаря тому, что размер мицелл гораздо больше размера молекул низкомолекулярных веществ. Простейшим прибором для диализа - диализатором - является мешочек из полупроницаемого материала (коллодия), в который помещается диализируемая жидкость. Мешочек опускается в сосуд с растворителем (водой). Периодически или постоянно меняя растворитель в диализаторе можно практически полностью удалить из коллоидного раствора примеси электролитов и низкомолекулярных неэлектролитов. Недостатком метода является большая длительность процесса очистки (недели, месяцы). Отчасти также недостатком диализа является факт, что длительный диализ обусловливает не только удаление из раствора примесей, но и стабилизатора, что может повлечь за собой коагуляцию коллоидного раствора. В настоящее время существует много усовершенствованных конструкций диализаторов, ускоряющих процесс диализа. Интенсификация процесса достигается увеличением поверхности, через которую идет диализ, непрерывной заменой растворителя и нагреванием, ускоряющем процесс. Процесс диализа обусловлен процессами осмоса и диффузии, что объясняет методы интенсификации процесса диализа. Электродиализ. Электродиализ - процесс диализа, ускоряемый действием электрического тока. Электродиализ применяют для очистки коллоидных растворов, загрязненных электролитами. В случае необходимости очистки коллоидных растворов от низкомолекулярных неэлектролитов, процесс электродиализа малоэффективен. В принципе, процесс электродиализа мало отличается от обычного диализа. Существенное отличие заключается в том, что с помощью внешнего электрического поля удается более быстро и полно отделить катионы и анионы электролитов от коллоидного раствора.
Простейший электродиализатор представляет собой сосуд, разделенный на 3 камеры. В среднюю камеру, снабженную мешалкой, наливают подлежащий очистке коллоидный раствор. В боковые камеры помещены электроды, подключенные к источнику постоянного тока и трубки для подвода и отвода растворителя (воды). Под действием электрического поля происходит перенос катионов из средней камеры в катодную камеру, а анионов - в анодную. Преимуществом электродиализа перед обычным диализом является малое количество времени, необходимое для очистки (минуты, часы). Следует отметить, что электродиализ особенно эффективен только после предварительной очистки с помощью обычного диализа, когда скорость диффузии из-за падения градиента концентрации электролитов между золем и водой мала и можно применять электрическое поле большого напряжения, не боясь сильного разогревания золя. Ультрафильтрация. Ультрафильтрация - фильтрование коллоидных растворов через полупроницаемую мембрану, пропускающую дисперсионную среду с низкомолекулярными примесями и задерживающую частицы дисперсной фазы или макромолекулы. Для ускорения процесса ультрафильтрации ее проводят при перепаде давления по обе стороны мембраны: под вакуумом или повышенным давлением. То есть, ультрафильтрация есть ничто иное, как диализ, проводимый под давлением. Ультрафильрация позволяет скорее отделить от коллоидного раствора электролиты и другие примеси (низкомолекулярные неэлектролиты), чем это происходит при диализе. При ультрафильтрации достигают высокой степени очистки золя, периодически разбавляя последний водой. При разбавлении водой золь будет содержать меньше низкомолекулярных примесей, но одновременно и стабилизаторов. На конечной стадии путем отсасывания дисперсионной среды можно сконцентрировать коллоидный раствор. При этом важно, что повышается концентрация только дисперсной фазы, состав же дисперсионной среды остается практически постоянным. Ультрафильтрация может применяться в сочетании с электродиализом (электроультрафильтрация), благодаря чему значительно ускоряется удаление электролитов из коллоидного раствора. Применение мембран с определенным размером пор позволяет разделить коллоидные частицы на фракции по размерам и ориентировочно определить эти размеры. Предложено много приборов для проведения ультрафильтрации. Так как ультрафильтрация всегда проходит под давлением, то во всех приборах для ультрафильтрации мембрана либо накладывается на пластинку с мелкими отверствиями, служащую для нее опорой, либо непосредственно получается на стенках неглазурованного фарфорового сосуда. Например, ультрафильтры Бехгольда получают путем нанесения на стенки пористого фарфорового сосуда разбавленного коллодия и последующего его высушивания.
Все это говорит о том, что ультрафильтрация является не только методом очистки коллоидных систем, но и может быть использована для дисперсионного анализа и препаративного разделения дисперсных систем. 3) Физико-химические принципы функционирования искусственной почки Почка искусственная — аппарат для выведения из крови больного токсических продуктов обмена веществ, которые накапливаются при тяжелом поражении почек (острая и хроническая почечная недостаточность). В основе работы аппарата лежит принцип диализа — удаление низкомолекулярных веществ из коллоидных растворов за счет диффузии и разницы осмотического давления с обеих сторон полупроницаемой целлофановой мембраны. Ионы калия, натрия, кальция, хлора, молекулы мочевины, креатинина, аммиака и др. свободно проникают через поры целлофана. В то же время более крупные молекулы белка, форменные элементы крови и бактерии не могут преодолеть целлофанового барьера. 4) Молекулярно-кинетические свойства коллоидно-дисперсных систем: броуновское движение, диффузия, осмотическое давление, седиментационное равновесие Все свойства коллоидно-дисперсных систем можно разделить на три основные группы: молекулярно-кинетические, оптические и электрокинетические. Рассмотрим молекулярно-кинетические свойства коллоидных растворов, к ним относят: Броуновское движение – непрерывное хаотичное движение частиц по всему объему. Причем расстояние, на которое перемещается частица в данном направлении за определенное время (называемое смещением) будет тем больше, чем меньше вязкость дисперсионной среды и размер частиц, и чем выше температура. Другое молекулярно-кинетическое свойство – это диффузия. Диффузия – это самопроизвольный процесс выравнивания концентраций по всему объему под влиянием броуновского движения. Причем скорость диффузии возрастает с ростом температуры и уменьшением размера частиц и вязкости дисперсионной среды, т. е. от тех же факторов, что и смещение при броуновском движении. Третье молекулярно-кинетическое свойство коллоидных растворов – это осмотическое давление. Оно очень мало и с трудом поддается измерению. Это связано с тем, что осмотическое давление коллоидных растворов определяется не молярной концентрацией (p = CRT) находящегося в дисперсионной среде вещества, а числом частиц в единице объема, которое много меньше, чем концентрация.
По оптическим свойствам коллоидные растворы существенно отличаются от истинных растворов низкомолекулярных веществ и грубодисперсных систем. Это связано с тем, что в коллоидных растворах размер частиц соизмерим с длиной волны падающего света, поэтому наиболее характерными оптическими свойствами коллоидно-дисперсных систем являютсяопалесценция, эффект Фарадея-Тиндаля, адсорбция света поверхность коллоидных частиц. Опалесценция – это явление рассеяния света мельчайшими частицами (самосвечение каждой частицы). Поэтому окраска золей в отраженном и проходящем свете будет различной. Например, белые золи в проходящем свете имеют красно-желтую окраску, а в отраженном – голубоватую. Эффект Фарадея-Тиндаля (1857): образование светового конуса при прохождении луча света через коллоидный раствор. Для того, чтобы решить, является раствор коллоидным или нет, необходимо проверить его на эффект Фарадея-Тиндаля. Окраска коллоидно-дисперсных систем связана с адсорбцией света поверхности частиц. Если тело способно поглощать все длины волн падающего света, то оно называется абсолютно черным; если тело отражает свет, то оно называется белым. Большинство тел способно поглощать лишь часть спектра, т. е. они обладают избирательной адсорбцией, и этим объясняется интенсивная окраска коллоидно-дисперсных систем, которая во много раз превышает интенсивность окраски истинных растворов. К электрокинетическим свойствам относят электроосмос и электрофорез. Электроосмос – это явление перемещения жидкости в электрическом поле относительно неподвижной твердой поверхности (движение частиц дисперсионной среды). Электрофорез – явление перемещения твердых частиц в электрическом поле относительно неподвижной жидкости к электроду, знак которого противоположен заряду перемещающихся частиц (движение частиц дисперсной фазы). Эти явления впервые были обнаружены Ф. Ф. Рейссом(1909) при воздействии постоянного электрического тока на диспергированную в воде глину (рис. 9). Под действием электрического тока, отрицательно заряженные частицы глины перемещаются к аноду с зарядом «+», а дисперсная среда, имеющая положительно заряженные ионы водорода (H+) перемещается в сторону катода, с зарядом «-». При этом в трубке с анодом уровень жидкости уменьшается и раствор мутнеет, а в трубке с катодом уровень жидкости увеличивается и она остается прозрачной. 5) Оптические свойства: рассеивание света (Закон Рэлея) Если коллоидные системы наблюдать в проходящем и боковом свете, то можно увидеть интересные явления: бесцветный золь в проходящем свете кажется прозрачным, а в боковом свете - мутным; луч света, проходя череззоль, оставляет в нем светлую полосу. Это явление называется опалесценцией. Если радиус частиц золя меньше длины полуволны падающего света (r < l/2), то луч света не отражается, а огибает частицу под различными углами. Это и является причиной рассеяния света.
Рэлей создал теорию этого явления, в первую очередь, для золей диэлектриков, не несущих на поверхности частиц заряда. В общем виде уравнение Рэлея: где I – интенсивность рассеянного света; I0 – интенсивность падающего света; А – постоянная. При r < (l/20) уравнение Рэлея имеет вид где n – частичная концентрация в дисперсной системе (число частиц в 1 см3); V – объем одной частицы; l – длина волны падающего света; n2, n1 – показатели преломления дисперсной фазы и дисперсионной среды. Из уравнения Рэлея следует, что яркость опалесценции растет с уменьшением длины волны.
6) Электрокинетические свойства: электрофорез и электроосмос; потенциал течения и потенциал седиментации СВЕТА, НА ПОЧИТАТЬ ^ 3.5 Электрокинетические явления Электрокинетические явления – это явления, которые возникают при воздействии электрического поля на дисперсную систему (электрофорез, электроосмос), а также в результате перемещения частиц дисперсной фазы или дисперсионной среды (потенциал протекания, потенциал оседания). Несмотря на различие электрокинетических явлений, все они связаны с наличием ДЭС на частицах дисперсной фазы. Интенсивность всех электрокинетических явлений определяется значением z-потенциала. Электрофорез Электрофорез – направленное движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля. При наложении внешнего электрического поля происходит разрыв мицеллы: частицы дисперсной фазы вместе с адсорбированными на них потенциалопределяющими ионами и противоионами адсорбционного слоя перемещаются к электроду, знак которого противоположен знаку заряда коллоидной частицы (z-потенциалу), а противоионы диффузионного слоя – к другому электроду. Например, если дисперсная фаза заряжена отрицательно, коллоидные частицы движутся к аноду (положительному электроду), а положительно заряженные противоионы диффузного слоя – к катоду (рис. 32).
Если дисперсная фаза заряжена положительно, направление движения частиц меняется на противоположное. С
где u – электрофоретическая скорость; z – электрокинетический потенциал; e – диэлектрическая проницаемость среды; e0 – электрическая постоянная, e0 = 8,85×10-12 Кл/(В×м); Е – разность потенциалов внешнего электрического поля; L – расстояние между электродами; E/L=H – напряженность, или градиент, внешнего электрического поля; m – динамическая вязкость сплошной среды; y – фактор формы. Коэффициент y учитывает форму частиц и их ориентацию в электрическом поле. Для шарообразных частиц коэффициент y равен 0,66, а для цилиндрических, ориентированных вдоль силовых линий электрического поля – 1. Скорость движения в расчете на единицу напряженности электрического поля ^ Н называется электрофоретической подвижностью
Электрофоретическая подвижность зависит только от свойств дисперсной фазы и дисперсионной среды. На подвижность коллоидной частицы оказывают влияние электрофоретический и релаксационный эффекты. ^ Электрофоретический эффект (эффект торможения): под действием внешнего электрического поля противоионы передвигаются в направлении, противоположном движению частицы. За счет гидратации противоионы увлекают за собой и окружающую их жидкость (дисперсионную среду). Это приводит к тому, что частица перемещаются в направлении, противоположном движению жидкости, скорость ее уменьшается. ^ Релаксационный эффект вызывается нарушением симметрии ДЭС вокруг частицы при ее движении. ДЭС деформируется и отстает от частицы. В результате возникает добавочное электрическое поле, которое действует на частицу, стремясь двигать ее в обратном направлении, и тем самым влияет на скорость электрофореза. Для учета влияния этих факторов в уравнение для расчета электрофоретической скорости и вводится коэффициент y. ^ Применение электрофореза. 1. Метод электрофореза широко используется для определения z-потенциала. Для этого измеряют электрофоретическую скорость при известной напряженности электрического поля. Наиболее простой метод – метод подвижной границы, в котором скорость движения частиц при электрофорезе оценивают по перемещению границы между прозрачной контактной жидкостью и окрашенным золем (рис. 33). При этом полагают, что все частицы движутся с одинаковой скоростью. Контактная жидкость представляет собой дисперсионную среду данного золя. Э
Зная скорость перемещения частиц и свойства дисперсионной среды (m и e), рассчитывают z-потенциал. 2. Разделение белков и других высокомолекулярных соединений, биологически активных веществ на фракции. 3. Нанесение ровных, тонких, прочных покрытий на металлические поверхности любой формы. 4. В медицине – для разделения и анализа белков, введения лекарственных препаратов. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху помещают электроды, к которым приложен низкий потенциал. В ходе этой процедуры частички лекарственного препарата под действием электрического поля переходят в ткани организма человека.
^ 3.5.2 Потенциал седиментации Потенциал седиментации – возникновение разности потенциалов при движении (седиментации) частиц в неподвижной жидкости. Рассмотрим коллоидную систему, находящуюся в емкости (например, отстойник) (рис. 34). Под действием силы тяжести частицы дисперсной фазы оседают. Процесс оседания частиц называют седиментацией. При оседании частиц дисперсионная среда практически остается неподвижной. Частицы движутся совместно с потенциалопределяющими ионами и адсорбционным слоем противоионов. Их перемещение относительно жидкой дисперсионной среды происходит по границе скольжения. Это приводит к тому, что диффузионная часть ДЭС отстает от частицы, поэтому в сплошной среде концентрируются противоионы. Чем выше уровень, тем концентрация противоионов выше. Между верхом и низом возникает разность потенциалов, которую и называют потенциалом оседания (седиментации). Потенциал седиментации обратен электрофорезу. И в том и в другом случае происходит движение частиц. Но при электрофорезе перемещение происходит в результате взаимодействия электрического поля с избыточным зарядом частиц, а при потенциале седиментации – в процессе оседания частиц возникает разность потенциалов. Электроосмос Э лектроосмос – движение дисперсионной среды через неподвижную капиллярно-пористую перегородку под действием внешнего электрического поля. Электроосмос обычно происходит в капиллярах и каналах пористых тел. Пусть в центр U-образной трубки помещена мембрана, представляющая собой мелкопористый стеклянный фильтр (рис. 35). Трубка заполнена электропроводящей жидкостью (водой). Рассмотрим сечение одного капилляра (рис. 36). Возникновение заряда на стенках капилляров стеклянного фильтра происходит за счет диссоциации молекул поверхностного слоя:
Ионы Са2+ переходят в раствор, а SiO32– связаны с кристаллической решеткой стекла и создают на поверхности капилляра отрицательный заряд, т.е. являются потенциалопределяющими ионами. Возле стенок капилляра формируется ДЭС. Пленка жидкости вместе с противоионами адсорбционного слоя «прилипает» к стенке капилляра и остается неподвижной. А противоионы диффузной части ДЭС под действием внешнего электрического поля перемещаются к катоду. Противоионы гидратированы, следовательно, вместе с ними к отрицательному электроду двигается и дисперсионная среда (вода). Таким образом, перемещение дисперсионной среды относительно стенок капилляров происходит по плоскости скольжения. В результате в левой части трубки уровень жидкости понижается, а в правой – повышается. Процесс прекратится, когда гидростатическое давление достигнет величины, достаточной для того, чтобы воспрепятствовать движению противоионов. ^ Применение электроосмоса. Метод электроосмоса, как и электрофореза широко используется для определения z-потенциала. Электроосмос применяют при обезвоживании древесины и пористых материалов: продуктов питания, сырья для пищевой промышленности (сахарных сиропов, желатина) и т.д. Влажную массу помещают между электродами и вода в зависимости от заряда противоионов ДЭС движется к одному из них и собирается в специальной емкости. ^ 3.5.4 Потенциал течения П Как и в других электрокинетических явлениях, в этом случае перемещение жидкой дисперсионной среды относительно дисперсной фазы происходит по плоскости скольжения. При движении жидкости под действием внешнего источника, например, насоса за нею увлекаются противоионы диффузного слоя. В результате концентрация противоионов перед пористой перегородкой и после нее будет сильно различаться. Если по обеим сторонам пористой перегородки поместить электроды, то включенный в цепь вольтметр покажет разность потенциалов, которую называют потенциалом течения. Потенциал течения обратен электроосмосу: в обоих случаях происходит движение дисперсионной среды, однако в случае электроосмоса она перемещается под действием электрического поля, а в случае потенциала течения – в результате внешнего воздействия. Потенциал течения возникает при перекачке по трубопроводам технологических растворов, жидкого топлива, и так же как потенциал седиментации может являться причиной пожаров и взрывов. Возле стенок трубопровода формируется ДЭС, диффузная часть которого уносится вместе с перекачиваемой жидкостью. В результате концентрация противоионов в начале трубопровода снижается, а в конце увеличивается; возникает потенциал течения. Протяженность трубопроводов велика, поэтому значение потенциала может быть достаточно высоким. Потенциал течения тем выше, чем больше вязкость жидкости и расстояние между электродами и чем меньше электрическая проводимость перекачиваемой жидкости. Например, при перекачке нефти, которая имеет низкую электропроводность и высокую вязкость, потенциал течения может достигать сотен вольт. Поэтому для предотвращения возгорания нефти необходимо принимать меры для предотвращения возникновения потенциала течения. 7) Строение двойного электрического слоя В дисперсных системах на поверхности частиц (на границе раздела частица-дисперсионная среда) возникает двойной электрический слой (ДЭС). Двойной электрический слой представляет собой слой ионов, образующийся на поверхности частицы в результате адсорбции ионов из раствора или диссоциации поверхностных соединений. Поверхность частицы приобретает слой ионов определенного знака, равномерно распределенный по поверхности и создающий на ней поверхностный заряд. Эти ионы называют потенциалопределяющими (ПОИ). К поверхности частицы из жидкой среды притягиваются ионы противоположного знака, их называют противоионами (ПИ). Таким образом, двойной электрический слой состоит из потенциалопределяющих ионов и слоя противоионов, расположенных в дисперсионной среде. Слой противоионов состоит из двух слоев: ·Адсорбционный слой (плотный слой), примыкающий непосредственно к межфазной поверхности. Данный слой формируется в результате электростатического взаимодействия с потенциалопределяющими ионами и специфической адсорбции. ·Диффузный слой, в котором находятся противоионы. Эти противоионы притягиваются к частице за счет электростатических сил. Толщина диффузного слоя зависит от свойств системы и может достигать больших значений. При движении частицы двойной электрический слой разрывается. Место разрыва при перемещении твердой и жидкой фаз друг относительно друга называется плоскостью скольжения. Плоскость скольжения лежит на границе между диффузными и адсорбционными слоями, либо в диффузном слое вблизи этой границы. Потенциал на плоскости скольжения называют электрокинетическим или дзета-потенциалом (ζ -потенциал).
8) Электрокинетический потенциал и его зависимость от различных факторов.
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 578; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.80.45 (0.075 с.) |
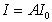 , (2.2.102)
, (2.2.102) , (2.2.103)
, (2.2.103) ,
,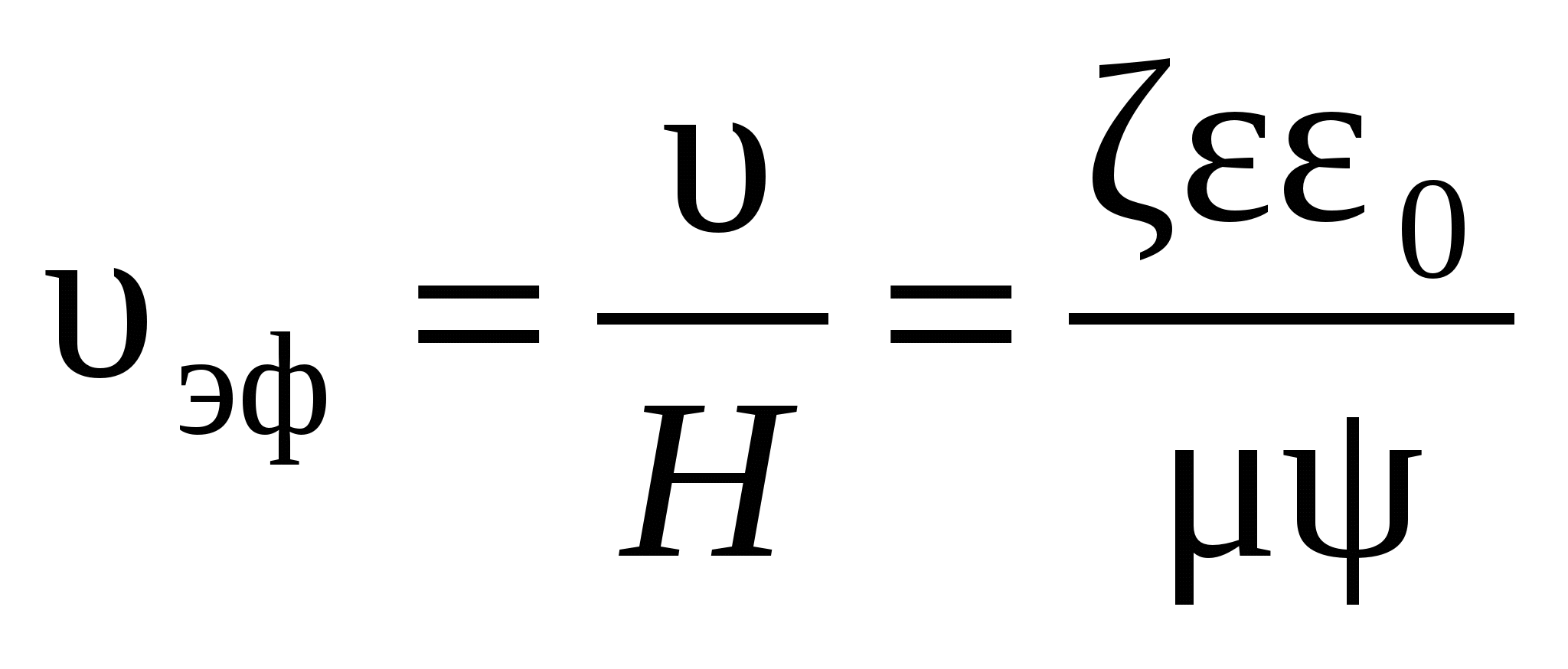 .
. .
. .
.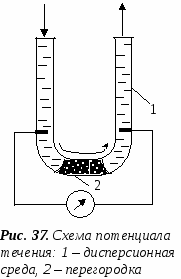 отенциал течения (протекания) – это явление возникновения разности потенциалов при перемещении дисперсионной среды через капиллярно-пористую перегородку.
отенциал течения (протекания) – это явление возникновения разности потенциалов при перемещении дисперсионной среды через капиллярно-пористую перегородку.


