Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Составление названия органического соединения.
Основу названия соединения составляет корень слова, обозначающий предельный углеводород с тем же числом атомов, что и главная цепь (мет-, эт-, проп-, бут-, пен-, гекс- и т. д.). Затем следует суффикс, характеризующий степень насыщенности, -ан, если в молекуле нет кратных связей, -ен при наличии двойных связей и -ин для тройных связей, (например пентан, пентен, пентин). Если кратных связей в молекуле несколько, то в суффиксе указывается число таких связей: -диен, -триен, а после суффикса обязательно арабскими цифрами указывается положение кратной связи (например, бутен-1, бутен-2, бутадиен-1,3):
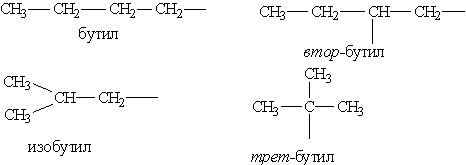
Далее в суффикс выносится название самой старшей характеристической группы в молекуле с указанием ее положения цифрой. Прочие заместители обозначаются с помощью приставок. При этом они перечисляются не в порядке старшинства, а по алфавиту. Положение заместителя указывается цифрой перед приставкой, например: 3-метил; 2-хлор и т. п. Если в молекуле имеется несколько одинаковых заместителей, то перед названием соответствующей группы словом указывается их количество (например, диметил-, трихлор- и т. д.). Все цифры в названиях молекул отделяются от слов дефисом, а друг от друга запятыми. Углеводородные радикалы имеют свои названия. Предельные углеводородные радикалы:
Непредельные углеводородные радикалы:
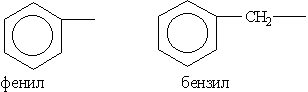
Ароматические углеводородные радикалы:
В качестве примера назовем следующее соединение:
1) Выбор цепи однозначен, следовательно, корень слова — пент; далее следует суффикс -ен, указывающий на наличие кратной связи; 2) порядок нумерации обеспечивает старшей группе (—ОН) наименьший номер; 3) полное название соединения заканчивается суффиксом, обозначающим старшую группу (в данном случае суффикс -ол указывает на наличие гидроксильной группы); положение двойной связи и гидроксильной группы указывается цифрами. Следовательно, приведенное соединение называется пентен-4-ол-2.. Классификация реакций в органической химии. Органические реакции классифицируют по направлению(1), по механизму(2) и по молекулярности(3): 1. По направлению и конечному результату различают следующие реакции: реакции присоединения, реакции отщепления, реакции замещения, перегруппировки В органических реакциях различают субстрат и реагент. Реагентом называют молекулу, атакующую субстрат в ходе осуществления реакции.
2. По механизму или характеру реагирующих частиц и типу разрыва ковалентной связи реакции делятся на: - гомолитические(радикальные) реакции сопровождаются гомолитическим разрывом ковалентной связи. Реагентами, (как и промежуточными частицами), в таких реакциях обычно являются радикалы (частицы с неспаренным), либо молекулы, легко разрушающиеся до радикалов в условиях реакции, или атомы. Новая связь при этом образуется за счет электронов и реагента, и субстрата. Условия осуществления гомолитических реакций включают газовую фазу или неполярный растворитель, высокие температуры или воздействие светом (излучением) высокой энергии; - гетеролитические(ионные, полярные) реакции сопровождаются гетеролитическим распадом связи. В отличие от гомолитических такие реакции протекают в полярной среде при умеренных температурах и нередко требуют присутствия катализатора. Гетеролитические реакции по характеру реагента подразделяются на два типа: Нуклеофильные реакции, в которых образование новой связи осуществляется за счет электронов реагента (нуклеофила). Электрофильные реакции, в которых образование новой связи осуществляется за счет электронов субстрата; реагент – электрофил. Классификация реагентов проводится по наличию сродства к ядру (нуклеофилы); к электронам - (электрофилы) или к атомам - (радикалы). Первые два типа реагентов имеют четное число электронов, радикалы несут неспаренный электрон. Нуклеофильные реагенты – это анионы или молекулы со свободными электронными парами (или образующие их в ходе реакции), либо содержащие легко поляризующиеся электронные оболочки (алкены, арены), которые участвуют в реакциях, предоставляя свои электроны для образования новой связи, и атакуют в молекуле субстрата участок с дефицитом электронов (где заряд ядра не полностью скомпенсирован орбитальными электронами): Типичные нуклеофилы -:OH,:Hal,:CN, HOH,:NH3. Электрофильные реагенты – это катионы или молекулы, содержащие атомы с незаполненными электронными орбиталями, действие которых связано с приобретением электронной пары в ходе реакции. Электрофилы атакуют в субстрате участок с избытком электронной плотности.
Типичные электрофилы – Br+ , H+, HCl, Br2 , AlCl3, HOBr, H3O+, HNO3(NO2+). Нуклеофилы – доноры электронов, электрофилы – их акцепторы. 3. По молекулярности. Молекулярность органической реакции определяют по числу молекул, в которых происходит реальное изменение ковалентных связей на самой медленной стадии реакции, определяющей ее скорость. Различают следующие виды реакций: - мономолекулярные – на лимитирующей стадии участвует одна молекула; - бимолекулярные– таких молекул две и т.д.
Раздел 1. УГЛЕВОДОРОДЫ
|
||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 94; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.81.206 (0.005 с.) |