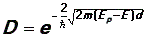Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергия частицы в бесконечной прямоугольной яме
En = Используя граничные условия, имеем: Ψ(x = 0) = a sin α = 0 Отсюда, α = 0 Ψ(x = 1) = a sin ωl = 0 Отсюда, ωl = ± nπ (n = 1,2, …) Учитывая значения ω, получим: En = ħ2π2/2ml n2 (n = 1, 2, …) En – собственные значения энергии. 14. Прохождение частиц через полубесконечный потенциальный барьер высотой U0 (E > U0) В классической механике прохождение частицы через потенциальный барьер возможно лишь в том случае, если её полная (кинетическая + потенциальная) энергия E превышает высоту потенциального барьера: E > U0; тогда частица пролетает над барьером.
В квантовой механике, в отличие от классической, возможно отражение от потенциального барьера. частиц с энергией E > V0.
Такие особенности поведения частиц в квантовой физике непосредственно связаны с корпускулярно-волновой природой микрочастиц.
15. Прохождение частиц через полубесконечный потенциальный барьер высотой U0 (E < U0) Если энергия частицы недостаточна для преодоления барьера, E < U0, то в некоторой точке x1 частица, движущаяся слева направо, останавливается и затем движется в обратном направлении. То есть потенциальный барьер является как бы непрозрачной стенкой, барьером, для частиц с энергией, меньшей высоты потенциального барьера. В квантовой механике, в отличие от классической, возможно прохождение через потенциальный барьер частиц с энергией E < U0. Такие особенности поведения частиц в квантовой физике непосредственно связаны с корпускулярно-волновой природой микрочастиц.
16. Туннельный эффект - преодоление микрочастицей потенциального барьера в случае, когда её полная энергия (остающаяся при туннелировании неизменной) меньше высоты барьера. Туннельный эффект — явление исключительно квантовой природы, невозможное в классической механике; аналогом туннельного эффекта в волновой оптике может служить проникновение световой волны внутрь отражающей среды (на расстояния порядка длины световой волны) в условиях, когда, с точки зрения геометрической оптики, происходит полное внутреннее отражение. Коэффициент прозрачности барьера D: Коэффициент прозрачности характеризует вероятность прохождения частицы сквозь барьер. Эта вероятность очень сильно зависит от толщины барьера d: чем толще барьер, тем меньше вероятность туннельного эффекта.
Атомная физика 17. Модель Бора выявила истинное значение спектральных законов и позволила установить, как эти законы отражают квантовый характер внутренней структуры атома - устойчивость структуры атома оказалась неразрывно связанной с существованием квантов. В модели Бора каждый атом обладает некоторой последовательностью квантовых (стационарных) состояний. Каждый вид атома имеет свою последовательность квантовых значений энергии, соответствующих различным возможным стационарным состояниям. Постулаты Бора: · В атоме существует ряд дискретных стационарных состояний, которым соответствуют определенные значения энергии атома E1, E2 и т.д. В стационарном состоянии атом не излучает и не поглощает энергии.
· 2) Переходя из одного стационарного состояния в другое, атом излучает и поглощает квант энергии ε = hv, равный разности энергий En и En' двух стационарных состояний: hv = En' - En. Недостатки теории Бора: · - не смогла объяснить интенсивность спектральных линий. · - справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева. · - теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно - уравнение движения электрона - классическое, другое - уравнение квантования орбит - квантовое. Опыт Франка - Герца - опыт, явившийся экспериментальным доказательством дискретности внутренней энергии атома. В опыте наблюдался монотонный рост I при увеличении ускоряющего потенциала вплоть до 4,9 в, то есть электроны с энергией Е < 4,9 эв испытывали упругие соударения с атомами Hg и внутренняя энергия атомов не менялась. При значении V = 4,9 в (и кратных ему значениях 9,8 в, 14,7 в) появлялись резкие спады тока. Это определённым образом указывало на то, что при этих значениях V соударения электронов с атомами носят неупругий характер, т. е. энергия электронов достаточна для возбуждения атомов Hg. При кратных 4,9 эв значениях энергии электроны могут испытывать неупругие столкновения несколько раз.
Таким образом, опыт Франка - Герца показал, что спектр поглощаемой атомом энергии не непрерывен, а дискретен, минимальная порция (квант электромагнитного поля), которую может поглотить атом Hg, равна 4,9 эВ. Значение длины волны λ = 253,7 нм свечения паров Hg, возникавшее при V > 4,9 В, оказалось в соответствии со вторым постулатом Бора.
18. В основу Квантово-механической теории строения атома положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями (эдакие "электронные облака" - области пространства в которых существует вероятность пребывания электрона). Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми Уравнение Шредингера для атома водорода:
где ψ - волновая функция (аналог амплитуды для волнового движения в классической механике), которая характеризует движение электрона в пространстве как волнообразное возмущение; x, y, z - координаты, m - масса покоя электрона, h - постоянная Планка, E - полная энергия электрона, E p - потенциальная энергия электрона.
Анализ решения уравнения Шредингера дает следующие результаты: · Электрон в атоме может иметь только определенные дискретные (квантованные) значения энергии, которые совпадают с выражением E=-(Z2me4/8ε02h2n2), где n – главное квантовое число. · 2. Орбитальный момент импульса L электрона в атоме также может принимать лишь ряд дискретных значений L=(h/2π)√l(l+1), Где l – орбитальное квантовое число. · 3. Проекция орбитального момента импульса Lz на выбранное направление OZ (например, направление внешнего магнитного поля) тоже квантуется Lz=(h/2π)m, где m – магнитное квантовое число.
Потенциал ионизации - разность электрических потенциалов, ускоряющая электрон до энергии, равной работе ионизации. Потенциал ионизации измеряется в вольтах и является индивидуальной характеристикой вещества. Различают:
19. Квантование энергии, момента импульса и проекции момента импульса электрона в атоме водорода · Электрон в атоме может иметь только определенные дискретные (квантованные) значения энергии, которые совпадают с выражением E=-(Z2me4/8ε02h2n2), где n – главное квантовое число. · 2. Орбитальный момент импульса L электрона в атоме также может принимать лишь ряд дискретных значений L=(h/2π)√l(l+1), Где l – орбитальное квантовое число. · 3. Проекция орбитального момента импульса Lz на выбранное направление OZ (например, направление внешнего магнитного поля) тоже квантуется Lz=(h/2π)m, где m – магнитное квантовое число. Дальнейшие исследования показали, что помимо указанных орбитальных характеристик электрон обладает также собственным моментом импульса Ls.
Атом водорода (Z = 1) имеет наиболее простой линейчатый спектр излучения. Частоты спектральных линий для атома водорода и водородоподобных атомов определяются по формуле:
v = Rv(1/n2 – 1/n'2), где Rv = Z2me4/8ε02h3 = 3,29 · 1015 с-1 – постоянная Ридберга. Также эта формула может быть записана через длину волны λ: 1/λ = Rλ(1/n2 – 1/n'2), где Rλ = 1,097 · 107 м-1.
20. Вырождение энергетических уровней -существование двух или более стационарных состояний квантовой системы (атома, молекулы) с одинаковыми значениями энергии. Система, полная энергия которой определяется заданием оператора Я (гамильтониана), может иметь т стационарных состояний, для которых уравнение Шредингера Hφi = Eφi определяет соответствующие волновые функции φi (i = 1, 2,..., т) и одно значение энергии Е, одинаковое для всех т состояний. Энергетический уровень с энергией Е при m ≠ 1 называется вырожденным, число т различных независимых волновых функций - кратностью вырождения уровня. О состояниях с волновыми функциями φi говорят как о состояниях, вырожденных по энергии, или вырожденных состояниях. Если одному значению энергии отвечает одно состояние, т.е. m=1, уровень наз. невырожденным.
Для обозначения квантовых состояний с заданным значением орбитального квантового числа l используют следующие спектроскопические символы:
l 0 1 2 3 Обозначение s p q f подоболочки Для обозначения квантовых состояний с заданным значением главного квантового числа n используют следующие спектроскопические символы: n 1 2 3 4 Обозначение K L M N Оболочки
|
|||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 165; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.168.172 (0.013 с.) |
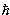 2a2/2m = n2
2a2/2m = n2 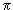 2
2