Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярные механизмы наркоманииСодержание книги
Поиск на нашем сайте
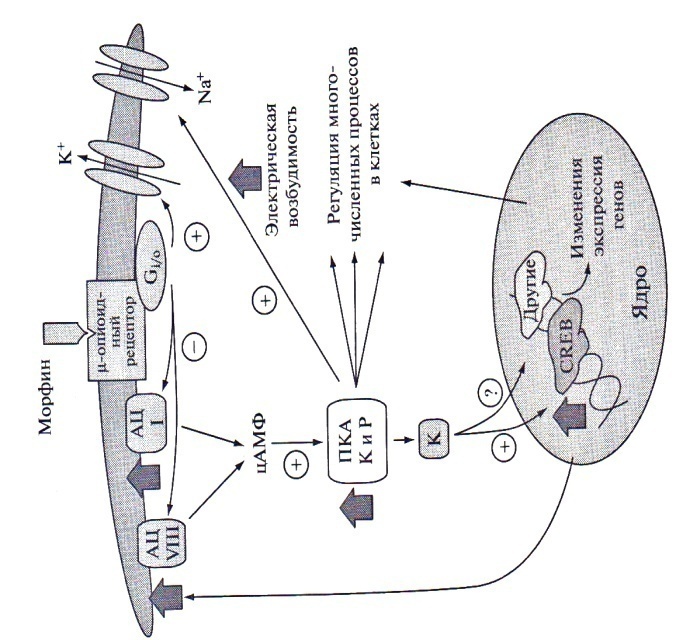
Различные наркотические вещества различаются по химической структуре и первоначальному действию. Тем не менее, развивающаяся при этом зависимость имеет много важных общих черт. Это объясняется тем, что несмотря на специфичность отдельных механизмов действия тех или иных препаратов, действие каждого наркотика сводится в конечном итоге к общим эффектам. Центральная роль в формировании наркотической зависимости принадлежит мезолимбической дофаминовой системе. Активация этой системы под действием наркотика включает ускоренное проведение импульса по дофаминовым нейронам в вентральной тегментальной зоне (англ. ventral tegmental area), принадлежащей к черной субстанции. Это приводит к усиленному высвобождению дофамина в область прилежащего ядра (nucleus accumbens, N. Acc), а также в другие области лимбической системы. Некоторые наркотики, такие как каннабиноиды и фенциклидин, действуют непосредственно на N. Acc. Тем не менее, итоговое воздействие на нейроны полосатого тела и прилежащего ядра оказывается однотипным. Это объясняется тем, что опиоидные, каннабиноидные и некоторые прочие дофаминергические рецепторы сопряжены с Gi-белками, экспрессируемыми нейронами прилежащего ядра. Мезолимбическая система среднего мозга, как и ее мишени, являются эволюционно древними образованиями, ответственными за реакции организма на естественные стимулы. Наркотики воздействуют на данные механизмы с гораздо большей силой, а повторная стимуляция этих нейронов приводит к изменению в них механизмов усиления сигнала. Это приводит к формированию следующих патологических функциональных состояний: 1) толерантность, отвечающая за необходимость повышения дозы наркотика в процессе развития наркотической зависимости. 2) зависимость, отвечающая за угнетенное состояние и высокую вероятность рецидива на ранних этапах отмены. 3) сенситизация, ответственная за повышенный риск рецидива после значительного периода воздержания от приема наркотика. Самым значительным этапом в молекулярном механизме развития наркотической зависимости является воздействие на уровень цАМФ. Однократное применение наркотиков, в частности опиоидного ряда, подавляет синтез цАМФ в нейронах многих отделов головного мозга. Однако, хроническое воздействие опиатов приводит к компенсаторной активации синтеза цАМФ. Данные компенсаторные механизмы включают активацию аденилатциклазы и ПКА в таких структурах мозга, как голубое пятно (синтез цАМФ усиливается в главных адренергических нейронах), тегментальная зона черной субстанции, околоводопроводное серое вещество, прилежащее и мендалевидное ядра и дорзальные ганглии спинного мозга, а также мышечно-кишечное нервное сплетение. Считается, что активация синтеза цАМФ происходит в ГАМК-ергических нейронах мезолимбической системы, которые иннервируют дофамин- и серотонинергические нейроны этой области. Когда воздействие опиатов прекращается и происходит формирование синдрома отмены, повышенный уровень цАМФ становится ответственным за развитие угнетенного состояния, связанного с усилением активности ГАМК-эргических нейронов. Наиболее детально данный механизм исследован в нейронах голубого пятна, - самого большого норадренергического пятна головного мозга. В норме, эти нейроны регулируют когнитивные функции, включая функцию внимания. Увеличение концентрации цАМФ в нейронах этой зоны, приводит к увеличению их возбуждения посредством увеличения неселективной проницаемости мембраны, что приводит к поведенческим реакциям, свойственным абстинентному синдрому. Последовательность событий в молекулярном механизме воздействия опиатов на клетки голубого пятна представлена на Рис. 3. Однократный прием опиатов приводит к активации опиоидных рецепторов, ассоциированных с белками Gi и G0, что приводит к ингибированию двух изоформ аденилатциклазы - I и VIII. Подавление синтеза цАМФ приводит к снижению активности ПКА и, следовательно, к подавлению фосфорилирования белков, образующих K+-ионные каналы. Это приводит у увеличению проницаемости мембраны для K+ и, в конечном счете, к подавлению активности нейронов голубого пятна.
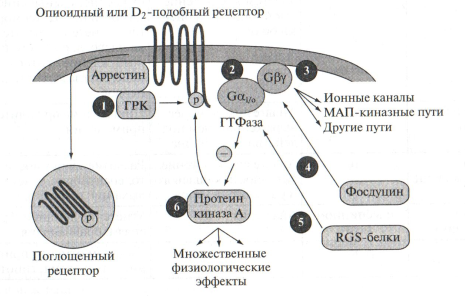
Рис. 3 Сигнальный механизм действия опиатов в нейронах голубого пятна. С другой стороны, снижение активности ПКА приводит к понижению уровня фосфорилирования ряда других белков, включая факторы транскрипции. Одним из таких факторов является белок CREB (англ. - cAMP-response element binding protein), регулирующий экспрессию многих генов, включая ген, кодирующий аденилатциклазу VIII. Повторный прием опиатов приводит к активации экспрессии обеих изоформ аденилатциклазы и, следовательно, к активации синтеза цАМФ и активности ПКА. Фосфорилирование Na+-зависимых ионных каналов приводит к увеличению проницаемости мембраны нейрона для Na+ и, соответственно, к ее деполяризации и началу процессов возбуждения в нейронах голубого пятна. Данные изменения функциональной активности нейронов лежат в основе формирования устойчивости и зависимости при приеме наркотических препаратов, а также отвечают за развитие абстиненции. В настоящее время, полный спектр сигнальных механизмов, вовлеченных в регуляцию нейрональной активности при воздействии наркотиков остается предметом дискуссий. Известно, что активация аденилатциклазы VIII происходит под влиянием CREB, в то время как механизм активации аденилатциклазы I остается невыясненным. Увеличение образования цАМФ при повторном приеме опиатов, кокаина или же алкоголя происходит также в прилежащем ядре. Прилежащее ядро, являясь составной частью мезолимбической системы, играет важную роль в формировании мотивационных состояний и принимает участие в образовании наркотической зависимости. D1-дофаминовые рецепторы действуют через активацию Gs-белков и активируют синтез цАМФ. Стимуляция этого механизма в N. Acc. определяет функциональную гиперчувствительность D1-дофаминовых рецепторов в результате хронического воздействия наркотиков. В основе формирования такой гиперчувствительности лежит, как полагают, фосфорилирование Na+-ионного канала ПКА. Известно, что хроническое воздействие наркотических веществ вызывает изменения уровня фосфорилирования CREB. Гены опиоидных пептидов, ферментов, принимающих участие в синтезе нейромедиаторов, сигнальных белков и транскрипционных факторов содержат CRE-участки, с которыми связывается регуляторный фактор транскрипции CREB и активирует транскрипцию. Белок CREB состоит из двух субъединиц, содержащих остатки Ser133. При фосфорилировании данных остатков белок CREB приобретает сродство к CRE-участку и присоединяется к нему, повышая тем самым активность связывания РНК-полимеразы с промотором регулируемого гена. Изменение интенсивности фосфорилирования/дефосфорилирования CREB приводит к изменению синтеза опиоидных пептидов и нейромедиаторов, участвующих в реализации воздействия наркотиков на клетки. Увеличение концентрации цАМФ и уровня фосфорилирования CREB приводит у активации синтеза опиоидного пептида динорфина, который экспрессируется в нейронах полосатого тела и прилежащего ядра и связывается с κ-опиоидными рецепторами, локализованными на пресинаптических дофаминсодержащих нервных окончаниях, локализованных в тегментальной области, прилежащей к черной субстанции. В результате происходит подавление высвобождения дофамина, что приводит к развитию угнетенного состояния. Изменение экспрессии CREB в ответ на хронический прием наркотиков регулируется по принципу отрицательной обратной связи. Снижение уровня цАМФ, вызываемое однократным приемом опиатов приводит к подавлению активности ПКА и уровня фосфорилирования CREB. Это приводит к активации экспрессии гена CREB через регуляторный CRE-участок, имеющийся в данном гене. Повышение продукции CREB активирует аденилатциклазу VIII и вызывает накопление цАМФ. Таким образом, в то время как в нейронах увеличивается экспрессия CREB, в них сохраняется низкий уровень цАМФ, поскольку опиаты, при однократном введении ингибируют аденилатциклазу через Gi-сопряженные рецепторы. Активация синтеза цАМФ при повторном введении наркотика представляет собой компенсаторную реакцию, имеющую место, в нейронах, секретирующих динорфин и ГАМК, и иннервирующих дофамин- и серотонинергические нейроны. Увеличение высвобождения ГАМК, вызванное активацией синтеза цАМФ, наблюдается при абстинентном синдроме. Хроническое поступление в организм наркотиков приводит к адаптации клеточных рецепторных механизмов, десенситизации клеток-мишеней и, как следствие к формированию устойчивости к действию препарата и необходимости увеличения его дозы. Одним из механизмов данного эффекта является фосфорилирование рецепторов с участием различных типов протеинкиназ. Фосфорилированный рецептор подвергается интернализации внутрь клетки, нарушается его сопряжение с G-белком, и развивается десенситизация. В процессах фосфорилирования опиоидных и дофаминовых рецепторов принимают участие G-белок-рецепторные протеинкиназы (ГРК) (Рис. 4-1), которые фосфорилируют только те рецепторы, которые связаны с лигандом. Фосфорилирование лиганд-рецепторного комплекса является сигналом для связывания с ним белков "аррестинов", вызывающих изоляцию рецепторов с клеточной поверхности. Еще один возможный механизм связан с насыщением околорецепторной зоны G-белками, их α- (Рис. 4-2) и βγ-субъединицами (Рис. 4-3), а также другими белками, такими как фосдуцин (Рис. 4-4) и RGS-белки (Рис. 4-5), модулирующими функции G-белков. Фосфорилирование рецептора ПКА не может опосредовать десенситизацию рецепторов, потому что активация рецептора ведет к ингибированию ПКА. Однако, увеличение активности ПКА (Рис. 4-6) при хроническом поступлении наркотиков в организм способно инициировать фосфорилирование и, таким образом, регулировать функциональное состояние рецепторов в процессе абстиненции.
Рис. 4 Механизм изменения чувствительности опиоидных и дофаминовых рецепторов к действию наркотиков Другой механизм развития устойчивости может быть связан с вызванными наркотиками модификациями K+- и Ca2+-ионных каналов, регулируемых G-белками.
|
||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 127; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.120.13 (0.007 с.) |