Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биосинтез фосфолипидов. Роль липотропных факторов.
Синтез фосфолипидов Биосинтез фосфолипидов по сравнению с синтезом ТАГ имеет существенные особенности. Они заключаются в дополнительной активации компонентов ФЛ – фосфатидной кислоты или холина и этаноламина. 1 путь – "спасательный" Благодаря этому пути холин и этаноламин используются повторно и не катаболизируют. Активация холина (или этаноламина) происходит через промежуточное образование фосфорилированных производных с последующим присоединением ЦМФ. В следующей реакции фосфохолин (или фосфоэтаноламин) переносится на ДАГ. Этот путь особенно характерен для легких и кишечника, но идет и в других тканях.
Путь – основной, синтез de novo Здесь холин (или этаноламин) не встраиваются в готовом виде, а образуются уже в молекуле фосфолипида. Активация фосфатидной кислоты заключается в присоединении к ней ЦМФ с образованием ЦДФ-ДАГ. Далее к нему присоединяется шестиатомный спирт инозитол или серин с образованием фосфатидилинозитола и фосфатидилсерина. Синтезированный фосфатидилсерин подвергается декарбоксилированию с образованием фосфатидилэтаноламина. Последний метилируется при участии S-аденозилметионина в фосфатидилхолин. Путь – обратное превращение Между фосфатидилэтаноламином и серином может происходить реакция с образованием в результате реакции фосфатидилсерина и свободного этаноламина. Липотропные вещества Все вещества, способствующие синтезу ФЛ и препятствующие синтезу ТАГ, и способные предотращать жировую инфильтрацию печени, называются липотропными факторами. К ним относятся: 1. Структурные компоненты фосфолипидов: полиненасыщенные жирные кислоты, инозитол, серин, холин, этаноламин. 2. Метионин – в виде S-аденозилметионина является донором метильных групп для синтеза холина и фосфатидилхолина. 3. Витамины: - пиридоксин (В6), способствующий образованию ФЭА из ФС. - цианкобаламин (В12) и фолиевая кислота, участвующие в реакциях обмена серина, глицина и метионина при ресинтезе метионина из гомоцистеина. Следовательно они, хотя и не напрямую, но необходимы для синтеза фосфатидилхолина. --- 35. Трансаминирование. Ферменты. Коферменты. Роль этого процесса для жизнедеятельности клетки. Диагностическое значение определения активности трансаминаз в сыворотке крови п
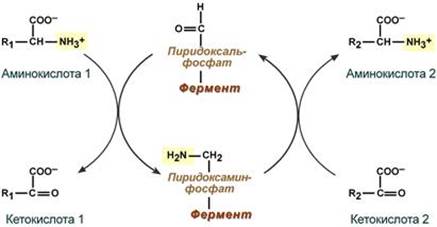
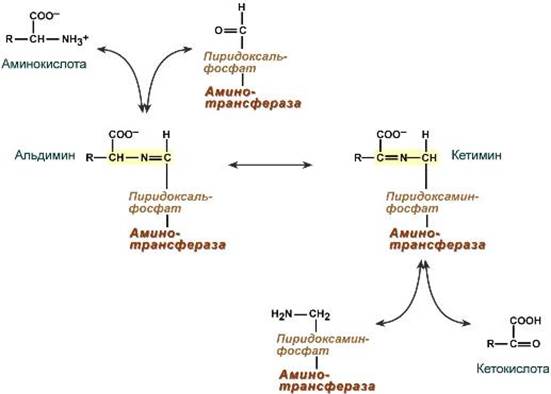
Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6). В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию. Весь перенос аминогруппы совершается в две стадии: - к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат. - на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами: - пировиноградной с образованием аланина, - щавелевоуксусной с образованием аспартата, - α-кетоглутаровой с образованием глутамата. Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты. Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование. ---
|
|||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 213; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.200.143 (0.004 с.) |