Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химические свойства алканоламинов и их водных растворов
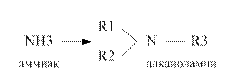
Алканоламины (аминоспирты, оксиамины) можно рассматривать как производные аммиака, в котором один или несколько атомов водорода замещены на спиртовой радикал или спиртовой и углеводородный:
где R1 – спиртовый радикал, например С2Н4ОН; R2, R3 – либо спиртовый, либо углеводородный радикал, либо Н+. По степени замещения атомов водорода при атоме азота алканоламины делятся первичные, вторичные и третичные: - первичные
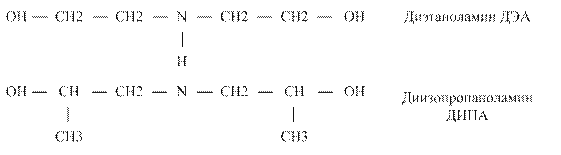
- вторичные
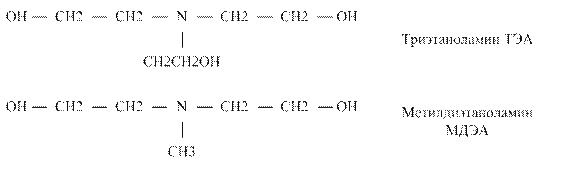
- третичные
Алканоламины содержат по крайней мере одну гидроксильную (-ОН) и одну аминогруппу. Присутствие гидроксильной группы снижает давление насыщенных паров и повышает растворимость амина в воде, а аминогруппа придает водным растворам щелочность, необходимую для взаимодействия с Н2S и СO2, которые в водной среде диссоциируют с образованием слабых кислот. Алканоламины - это бесцветные, вязкие, гигроскопичные жидкости, смешивающиеся с водой и низкомолекулярными спиртами во всех соотношениях; они почти нерастворимы в неполярных растворителях. Основные физико-химические свойства водных растворов приведены в таблице 1.2.1.
Таблица 1.2.1. Физико-химические свойства алканоламинов (массовое содержание вещества не менее 99%)
Некоторые физико-химические свойства водных растворов алканоламинов приведены на рисунках 1.2.1 – 1.2.6. Рисунок 1.2.1. Измерение рН 2н растворов аминов при нейтрализации СО2 (t=25 оС): 1 – МЭА; 2 – ДЭА; 3 – МДЭА; 4 – ТЭА.
Рисунок 1.2.2. Кривые температур замерзания водных растворов аминов: 1 – МЭА; 2 – МДЭА; 3 – ДЭА.
Рисунок 1.2.3. График температуры кипения водных растворов аминов при давлении 101,333 кПа.
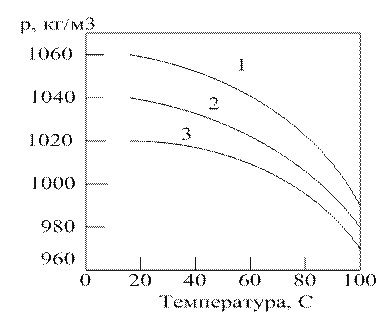
Рисунок 1.2.4. Зависимость плотности водных растворов МДЭА от температуры при различной массовой доле МДЭА, %: 1 – 60; 2 – 40; 3 – 20.
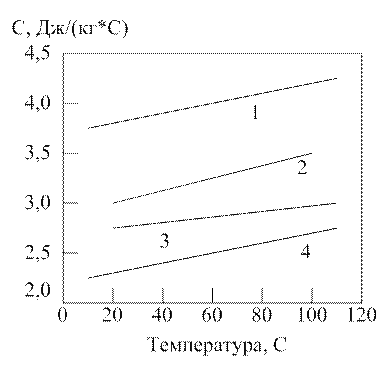
Рисунок 1.2.5. Зависимость теплоемкости водных растворов МДЭА от температуры при различной массовой доле МДЭА, %: 1 – 25; 2 – 50; 3 – 75; 4 – 100.
Рисунок 1.2.6. Зависимость теплопроводности растворов МДЭА от массовой доли МДЭА при температуре 40 оС.
Хемосорбенты применяют, как правило, в виде водных растворов. Концентрация амина в растворе может изменяться в широких пределах, ее выбирают на основании опыта работы и по соображениям борьбы с коррозией. Массовая концентрация алканоламинов в воде составляет 10-60%. Чистые амины – вязкие жидкости с высокой температурой замерзания (за исключением ДГА и МДЭА). Однако водные растворы этаноламинов менее вязкие и замерзают при низких температурах (ниже минус 10⁰С), что делает возможным их применение в промышленности.
1.3. Химизм взаимодействия Н2 S, C О2 и других компонентов с алканоламинами Механизм поглощения Н2S и СО2 водными растворами аминов подробно рассмотрен в работах [28-31]. Алканоламины, будучи щелочами, легко вступают в реакцию с кислыми газами Н2S (СO2), образуя водорастворимые соли. При этом протекают следующие реакции: Н2S + [Амин] ↔ [Амин ∙ Н]+ + НS- (мгновенно); СO2+2∙ [Амин] ↔ [Амин х Н]+ + [Амин ∙ СОО]- (быстро); СO2 + Н2O ↔ Н2СO3 (медленно); Н2СO3 ↔ Н+ + НСO3- (быстро) НСO3- ↔ Н+ + СO3- (быстро) [Амин] + Н+ ↔ [Амин ∙ Н]+ (быстро). Все амины реагируют с Н2S одинаковым образом с образованием гидросульфида или сульфида амина, причем реакция классифицируется как мгновенная. Первичные и вторичные амины могут реагировать с СO2 с образованием карбамата (соли замещенной карбаминовой кислоты - амин∙СОО-∙Н+), которая трактуется как быстрая реакция второго порядка. Кроме того, с СO2 образуются карбонаты и бикарбонаты аминов, но образованию их предшествует медленная реакция растворения СO2 в воде с образованием угольной кислоты Н2СO3. Считается, что при умеренных степенях карбонизации амина (до 0,5 моль СO2/моль амина) преимущественно протекает быстрая реакция образования карбамата. Карбаматы аминов - нестойкие соединения и в слабощелочной среде они медленно разлагаются с образованием бикарбоната (на примере вторичного амина):
R2NCOOR2NH2 + H2O ↔ R2NH + R2NH2HCO3 где R – HOCH2CH2-. У третичного алканоламина нет подвижного атома Н+ в аминовои группе (N -), поэтому становится невозможным про-текание прямой и быстрой реакции с СO2 по карбаматному типу, а взаимодействие осуществляется через предварительную и медленную стадию образования и диссоциации угольной кислоты: СО2+Н2О ↔ Н2СО3; Н2СО3 ↔ Н+ + НСО3-, [Амин] + Н++ НСО3- ↔ [Амин ∙ Н]+х НСO3-. Конечными продуктами реакции являются бикарбонат и карбонат. Таким образом, разница в скоростях реакций третичных аминов с Н2S (мгновенная реакция) и СO2 (медленная реакция) гораздо значительнее, чем для первичных и вторичных аминов. Это позволяет использовать на практике третичные амины для селективного извлечения Н2S из смесей его с СO2. Реакционная способность алканоламинов изменяется в ряду: первичные > вторичные > третичные и коррелируется с их щелочностью. Диоксид углерода образует с алканоламинами различные побочные продукты. Механизм их образования изучен не полностью. Часть из них на стадии регенерации абсорбента разрушается и снова выделяет алканоламин, другая часть нерегенерируется, что является одной из причин потерь амина. Наибольшее количество нерегенерируемых соединений характерно для первичных алканоламинов. Меркаптаны, будучи кислотами, обратимо реагируют с алканоламинами с образованием водородрастворимых меркаптидов: [Амин]+RSН ↔ [Амин ∙ Н] + ∙ RS-, где R - углеводородный радикал. Реакции предшествует растворение меркаптанов в абсорбенте и диссоциация на ионы: Н2O RSН ↔ RS- + Н+. Кислотность меркаптанов значительно ниже, чем Н2S и СO2, вследствие чего последние вытесняют меркаптаны из их соединения с аминами. Меркаптиды - нестойкие соединения, легко разрушающиеся при нагревании. На растворимость меркаптанов в алканоламинах значительное влияние оказывает наличие СO2 в растворе. Равновесная растворимость С2Н5SН в аминах при наличии СO2 в растворе в количестве 2 г/л (глубокая регенерация) снижается в 2,5 - 4 раза. С увеличением содержания СO2 в растворе растворимость С2Н5SН приближается к растворимости его в воде. При этом характер изменения растворимости соответствует изменению рН раствора. Таким образом, на промышленных установках аминовой очистки газа от Н2S и СO2 не представляется возможным одновременно полностью очистить газ от меркаптанов. Сероокись углерода в водных растворах аминов гидролизуется: СOS+Н2S ↔ СO2+Н2S. Образовавшиеся Н2S и СO2 реагируют с аминами. Однако ввиду того, что в исходном газе концентрация СОS по сравнению с Н2S и СO2 невелика, прямая реакция никогда не доходит до конца. Лимитирующая стадия процесса - растворение в абсорбенте. Сероокись углерода может непосредственно вступать в реакции с первичными и вторичными аминами с образованием тиокарбаматов (аналогично СO2). СOS способна вступать также в другие реакции с аминами, механизм которых изучен не до конца. При этом с первичными аминами образуются нерегенерируемые продукты: вторичные и третичные амины реагируют обратимо.
При создании в абсорбенте аминовой очистки газа зоны гидролиза СОS, состоящей из 6 - 10 практических тарелок, при температуре 60 - 80 °С можно извлечь из газа значительную (до 80 %) часть сероокиси углерода. Аналогичным образом реагирует с алканоламинами и сероуглерод. Побочные продукты он образует и с первичными и с вторичными аминами. Сульфиды и дисульфиды с алканоламинами не взаимодействуют. Процесс поглощения COS аминами определяется как физической растворимостью, так и химическим взаимодействием растворенной сероокиси углерода с аминами. С повышением температуры ратворимость COS в воде уменьшается. Хемосорбция COS водным раствором ДЭА сопровождается образованием тиокарбаминовой кислоты, которая диссоциирует в растворе и взаимодействует с ДЭА с образованием тиокарбамата амина. Тиокарбамат в водной среде гидролизуется, в результате чего образуется Н2S и СO2 , которые легко связываются с ДЭА.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 1387; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.182.45 (0.012 с.) |