Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость химической реакции. Химическое равновесие
Раздел химии, изучающий скорость химических реакций и механизмы их протекания называется химической кинетикой. Все реакции протекают во времени. Одни идут очень быстро (взрывы, горение), другие медленно (формирование горных пород). Но все реакции подчиняются общим законам. Все реакции можно разделить на две группы: 1. Гомогенные – реагирующие вещества находятся в одной фазе – газообразной или жидкой. N2 + 3H2 → 2NH3 2. Гетерогенные – реагирующие вещества находятся в разных фазах Газ – твердое тело Жидкость – Твердое тело Газ – жидкость С + O2 → CO2 Рассмотрим в общем виде химическую реакцию и изменение концентраций реагирующих веществ со временем: А + В → C + D Где: A и В – исходные вещества, С и D – продукты. За скоростью реакции можно следить по изменению концентрации любого вещества, как по исходному, так и по продуктам.
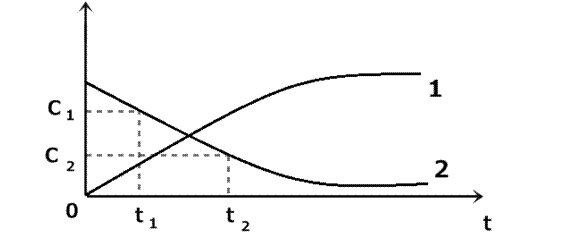
Рис. 1 Зависимость изменения концентрации продуктов (1) и исходных веществ (2) от времени. Допустим, мы следим за скоростью реакции по исходному веществу. В какой - то момент времени t 1 ему будет соответствовать концентрация С1, а моменту времени t 2 будет соответствовать концентрация С2. Тогда средняя скорость реакции будет описываться уравнением: V ср = - С2 - С1/ t 2 - t 1 или: V ср = - ∆С/∆ t « -», еслирасчет ведется по исходным веществам; «+», расчет ведется по продуктам реакции. Истинная скорость реакции: V ист = - dC / dt Скорость химической реакции – это изменение концентрации реагирующих веществ в единицу времени. Скорость гомогенной реакции – это количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объёма системы: V гомог = Размерность скорости гомогенной реакции: моль/ л ∙ с Скоростью гетерогенной реакции - это количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности раздела (или массы, объёма твердой фазы, когда затруднительно определение величины поверхности твёрдого тела): V гетерог = Размерность скорости гетерогенной реакции: моль/ м2∙с Факторы, влияющие на скорость реакции: 1. Природа вещества 2. Концентрация 3. Температура 4. Наличие катализаторов и ингибиторов
I. Влияние природы реагирующих веществ Все вещества реагируют с разной скоростью, но иногда можно выделить реакционные серии, например взаимодействие щелочных металлов с водой: 2 H 2 O + 2 Me →2 M е OH + H 2 Здесь химизм процесса – перенос электрона от металла к иону водорода. С Li – реакция идет медленно, Na – загорается, K – легче всего отдает электрон, реакция идет со взрывом. II. Влияние концентрации Пустьпроцесс превращения выражается уравнением: аА + bB → cC + dD где d, b, c, d – стехиометрические коэффициенты. Тогда скорость реакции выражается уравнением V = k [ A ] a × [ B ] b [A] и ×[B] – текущие концентрации веществ А и В. Это уравнение называется основным законом химической кинетики, или законом действующих масс (открыт К. Гульбергом и П. Вааге в1867 г.) Его формулировка: Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степени их коэффициентов. Здесь k - константа скорости реакции. Физический смысл k – она численно равна скорости при концентрации реагирующих веществ равной 1 моль/л. k зависит только от природы реагента и температуры не зависит от концентрации. Показатель степени, в который входит концентрация в уравнении для скорости называется порядком реакции. Например для реакции синтеза аммиака: N 2 + 3 H 2 → 2 NH 3 Порядок реакции по N2 – 1, по Н2 – 3, общий порядок реакции – 4 Кинетические уравнения получают экспериментально, порядок реакции может не совпадать со стехиометрическими коэффициентами. III. Влияние температуры В небольшом интервале температур достаточно точным является правило Вант – Гоффа: При повышении температуры на 10 градусов скорость реакции увеличивается в 2 – 4 раза. Vt 2 = Vt 1 g t 2 - t 1 /10 g ( гамма) – температурный коэффициент реакции, он показывает, во сколько раз изменится скорость реакции при повышении температуры на 10 градусов. Vt 1 - скоростьпри температуре t 1, Vt 2 - скоростьпри температуре t 2. Температурный коэффициент для разных реакций различен. При обычных температурах его значение для большинства реакций лежит в пределах от 2 до 4. Для более широкого интервала температур зависимость константы скорости k от температуры описывается уравнением Аррениуса (1889 г.):
k = k 0 × e - Ea / RT или в логарифмической форме: lnk = lnk 0 - Ea / RT, где k 0 - предэкспоненциальный множитель, имеющий смысл максимально возможного значения константы скорости при нулевой энергии активации или бесконечно высокой температуре, когда все столкновения молекул реагентов становятся активными. k – константа скорость реакции; R - универсальная газовая постоянная, равная 8,31 Дж/моль×К; e – основание натурального логарифма; T – температура в градусах Кельвина; Еа – энергия активации, Дж/моль. Влияние температуры на скорость реакции объясняет теория активации. Не все соударения молекул приводят к взаимодействию, а только эффективные, с образованием активных молекул, обладающих энергией, достаточной для взаимодействия (Еа). Энергия активации, это минимальная энергия, которой должна обладать система, что бы произошло взаимодействие. Пусть мы имеем реакцию: А + B → C + D. Изменение энергии такой системы выражается графиком, представленным на рис.2.
Рис.2 Зависимость энергии системы от координаты реакции. (Еа1- энергия активации каталитической реакции) АК(активированный комплекс) – неустойчивое образование, в котором ослабляются и удлиняются связи, разрываемые в ходе реакции. Рассмотрим на примере реакции: H2 + Cl2 → 2HCl H Cl H - - - - Cl H – Cl | + | → | | → H Cl H - - - - Cl H – Cl Исходные вещества Активированный Продукты реакции комплекс Координата реакции - это путь от исходного состояния в конечное через активированный комплекс Еа различных реакций различна. Посредством этого фактора сказывается влияние природы реагирующих веществ на скорость реакции. Если Еа<40 кДж/моль (т.е. мала), то скорость такой реакции велика (например, ионные реакции в растворах и радикальные реакции протекают практически мгновенно). Если Еа>120 кДж/моль (т.е. очень значительна), то скорость такой реакции незначительна (например, реакция синтеза аммиака N2+3H2=2NH3 – скорость этой реакции при обычных температурах вследствие высоких значений Еа настолько мала, что заметить её протекание практически невозможно).
|
||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 73; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.65.65 (0.008 с.) |
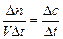 ;
;