Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механика. Основы молекулярнойСтр 1 из 7Следующая ⇒
ФИЗИКА
Методические рекомендации к практическим занятиям для студентов всех специальностей и направлений подготовки очной и заочной форм обучения МЕХАНИКА. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
Могилев 2018 УДК 535 ББК 22.33 Ф 55 Рекомендовано к изданию учебно-методическим отделом Белорусско-Российского университета
Одобрено кафедрой «Физика» «29» января 2018 г., протокол № 5
Составители: канд. физ.-мат. наук П. Я. Чудаковский; ст. преподаватель Н. С. Манкевич; ст. преподаватель В. Ф. Холомеев
Рецензент канд. тех. наук, доц. И. Д. Камчицкая
В методических рекомендациях приводятся общие требования к решению задач, основные понятия и формулы по разделам физики «Механика», «Молекулярная физика и термодинамика», а также таблицы физических постоянных.
Учебно-методическое издание
ФИЗИКА
Ответственный за выпуск А. В. Хомченко
Технический редактор П. Я. Чудаковский
Компьютерная верстка П. Я. Чудаковский
Подписано в печать 26.02.2018. Формат 60´84/16. Бумага офсетная. Гарнитура Таймс Печать трафаретная. Усл. печ. л. 2,09. Уч.-изд. л. 2,3. Тираж 50 экз. Заказ № 2440.
Издатель и полиграфическое исполнение: Государственное учреждение высшего профессионального образования «Белорусско-Российский университет». Свидетельство о государственной регистрации издателя, изготовителя, распространителя печатных изданий № 1/156 от 24.01.2014. Пр. Мира, 43, 212000, Могилев.
© ГУ ВПО «Белорусско-Российский университет», 2018
Содержание
1 Общие указания к решению задач. 4 2. Физические основы механики. 5 2.1 Основные формулы.. 5 2.2 Типовые задачи. 10 3 Молекулярная физика и термодинамика. 18 3.1 Основные формулы. 18 3.2 Типовые задачи. 23 Список литературы.. 31 Приложение А.. 32
Общие указания к решению задач Предлагаемые методические рекомендации содержат задачи из двух разделов общего курса физики в соответствии с учебными программами курса, читаемого на кафедре «Физика», «Механика» и «Молекулярная физика и термодинамика». Данное издание предназначено для самостоятельной работы студентов и проведения практических занятий.
Решения задач следует начинать с краткой записи условия с приведением его к СИ. Значения физических величин и постоянных представлены в таблицах А.1–А.14. Решения необходимо сопровождать краткими, но исчерпывающими пояснениями; в тех случаях, когда это возможно, дать чертеж, выполненный с помощью чертежных принадлежностей. Решать задачу надо в общем виде, т. е. выразить искомую величину в буквенных обозначениях величин, заданных в условии задачи. При таком способе решения не производятся вычисления промежуточных величин. После получения расчетной формулы для проверки ее правильности следует подставить в правую часть формулы вместо символов величин обозначения единиц этих величин, произвести с ними необходимые действия и убедиться в том, что полученная при этом единица соответствует искомой величине. Если такого соответствия нет, то это означает, что задача решена неверно. Числовые значения величин при подстановке их в расчетную формулу следует выражать только в единицах СИ. В виде исключения допускается выражать в любых, но одинаковых единицах числовые значения однородных величин, стоящих в числителе и знаменателе дроби и имеющих одинаковые степени. При подстановке в расчетную формулу, а также при записи ответа числовые значения величин следует записывать как произведение десятичной дроби с одной значащей цифрой перед запятой на соответствующую степень десяти. Например, вместо 3520 надо записать 3,52 · 103, вместо 0,00129 записать 1,29 · 10–3 и т. п. Вычисления по расчетной формуле необходимо проводить с соблюдением правил приближенных вычислений [6]. Как правило, окончательный ответ следует записывать с тремя значащими цифрами. Это относится и к случаю, когда результат получен с применением калькулятора. Физические основы механики
Основные формулы Кинематическое уравнение движения материальной точки (центра масс твердого тела) вдоль оси x: x = f (t), где x – некоторая функция времени t.
Проекция средней скорости на ось x
Средняя путевая скорость
где Δ s – путь, пройденный точкой за интервал времени Δ t. Путь Δ s в отличие от разности координат Δ x = x 2 – x 1 не может убывать и принимать отрицательные значения, т. е. Δ s
Проекция среднего ускорения на ось x
Проекция мгновенного ускорения на ось x
Кинематическое уравнение движения материальной точки по окружности φ = f(t) (r = R = const),
где φ – угловое перемещение. Модуль угловой скорости
Модуль углового ускорения
Связь между модулями линейных и угловых величин, характеризующих движение точки по окружности:
V = ω · R; a τ = ε · R; a n = ω 2 · R,
где V – модуль линейной скорости; a τ и a n – модули тангенциального и нормального ускорений; ω – модуль угловой скорости; ε– модуль углового ускорения; R – радиус окружности. Модуль полного ускорения
Угол между полным
α = arccos(a n / a).
Импульс материальной точки массой m, движущейся со скоростью
Второй закон Ньютона
где Силы, рассматриваемые в механике: – сила упругости
где k – коэффициент упругости (в случае пружины – жесткость); D – сила гравитационного взаимодействия
F = γ где γ – гравитационная постоянная; m 1 и m 2 – массы взаимодействующих тел; r – расстояние между телами (тела рассматриваются как материальные точки); – сила тяжести
где g – ускорение свободного падения. В случае гравитационного притяжения тела к Земле
где М и R – масса и радиус Земли соответственно; – сила трения (скольжения) F = μ · N,
где μ – коэффициент трения; N – сила нормального давления. Закон сохранения импульса
для двух тел (i = 2)
где Кинетическая энергия тела, движущегося поступательно,
T = m · V 2 / 2
или T = p 2 / 2 m.
Потенциальная энергия: – упругодеформированной пружины
П = k · x 2 / 2,
где k – жесткость пружины; x – абсолютная деформация; – гравитационного взаимодействия
где γ – гравитационная постоянная; m 1 и m 2 – массы взаимодействующих тел; r – расстояние между телами (тела рассматриваются как материальные точки); – тела, находящегося в однородном поле силы тяжести,
П = m · g · h,
где g – ускорение свободного падения; h – высота тела над уровнем, принятым за нулевой (формула справедлива при условии h << R, здесь R – радиус Земли). Закон сохранения механической энергии
E = T + П = const.
Работа А, совершаемая результирующей силой, определяется как мера изменения кинетической энергии материальной точки:
А =
Основное уравнение динамики вращательного движения относительно неподвижной оси z
где
J z – момент инерции относительно оси вращения. Моменты инерции некоторых тел массой m относительно оси z, проходящей через центр масс:
– стержня длиной L относительно оси, перпендикулярной стержню,
– обруча (тонкостенного цилиндра) относительно оси, перпендикулярной плоскости обруча (совпадающей с осью цилиндра),
J z = m · R 2,
где R – радиус обруча (цилиндра); – диска радиусом R относительно оси, перпендикулярной плоскости диска,
Проекция на ось z момента импульса тел, вращающихся относительно неподвижной оси z,
L z = J · ω,
где ω – угловая скорость тела. Закон сохранения момента импульса систем тел, вращающихся вокруг неподвижной оси z,
J z ·
где J z – момент инерции системы тел относительно оси z;
Кинетическая энергия тела, вращающегося вокруг неподвижной оси z,
или T = L z2 / (2 J z).
Релятивистское (лоренцево) сокращение длины стержня
где l 0 – длина стержня в системе, относительно которой стержень покоится (собственная длина); l – длина стержня, относительно которой он движется; β – скорость частицы, выраженная в долях скорости света, β = V / c. Промежуток времени ∆ t в системе, движущейся по отношению к наблюдателю, связан с промежутком времени ∆ t 0 в неподвижной для наблюдателя системе отношением
Релятивистская масса
где m0 – масса покоя. Релятивистский импульс
Полная энергия релятивистской частицы
где Т – кинетическая энергия частицы; Е 0 – энергия покоя частицы, Связь полной энергии с импульсом релятивистской частицы
Связь кинетической энергии с импульсом релятивистской частицы
Типовые задачи Релятивистская механика 2.76 Определить скорость, при которой релятивистское сокращение линейных размеров тела составляет 10 %. 2.77 Собственное время жизни нестабильной частицы ∆to = 10 нс. Какой путь пролетит эта частица до распада в лабораторной системе отсчета, где ее время жизни ∆t = 20 нс? 2.78 В системе К' покоится стержень, собственная длина которого равна 1 м. Стержень расположен так, что составляет угол 45º с осью Х'. Определить длину системы стержня и угол в системе К, если скорость системы К′ относительно К равна 0,8 с. 2.79 Определить релятивистский импульс электрона, кинетическая энергия которого Т = 1 ГэВ. 2.80 Сколько времени пройдет на земле, если в ракете, движущейся со скоростью v = 0,95 с относительно Земли, пройдет t = 10 лет?
2.81 Один близнец отправляется в космическое путешествие, другой остается на Земле, причем путешествие длится 40 лет (по земным часам) со скоростью v = 0,2 с. Определить, на сколько моложе окажется космический путешественник. 2.82 Во сколько раз релятивистская масса частицы, скорость которой отличается от скорости света на 0,01 %, превышает ее массу покоя? 2.83 Найти скорость, при которой релятивистский импульс частицы в 2 раза превышает её ньютоновский импульс. 2.84 Какую работу надо совершить, чтобы увеличить скорость частицы с массой m от 0,6 до 0,8 с? Сравнить результат со значением. вычисленным по нерелятивистской формуле. 2.85 При какой скорости кинетическая энергия любой частицы равна ее энергии покоя?
Основные формулы. Количество вещества тела (системы)
ν = N / N A,
где N – число структурных элементов (молекул, атомов, ионов и т. п.), составляющих тело (систему); N A – постоянная Авогадро, N A= 6,02 · 1023 моль–1. Молярная масса вещества μ = m / ν,
где m – масса однородного тела (системы); ν – количество вещества этого тела. Количество вещества смеси газов
ν = ν 1 + ν 2 +... + ν n = N 1 / N A + N 2 / N A +... + Nn / N A или ν = m 1 / μ 1 + m 2 / μ 2 +... + mn / μ n,
где νi, Ni, mi, μi – количество вещества, число молекул, масса, молярная масса i -го компонента смеси соответственно. Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа) p · V = ν · R · T = где m – масса газа; μ – молярная масса газа; R – молярная газовая постоянная; ν – количество вещества; T – термодинамическая температура. Опытные газовые законы, являющиеся частными случаями уравнения Менделеева-Клапейрона для изопроцессов: – закон Бойля-Мариотта (изотермический процесс: T = const, m = const) p · V = const,
или для двух состояний газа p 1 · V 1 = p 2 · V 2;
– закон Гей-Люссака (изобарный процесс: p = const, m = const)
или для двух состояний газа
– закон Шарля (изохорный процесс: V = const, m = const)
или для двух состояний
– объединенный газовый закон (m = const)
где p 1, V 1, T 1 и p 2, V 2, T 2 – давление, объем и температура газа в начальном и конечном состояниях соответственно. Закон Дальтона, определяющий давление смеси газов,
p = p 1 + p 2 +...+ pn,
где p i – парциальные давления компонентов смеси; n – число компонентов смеси. Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью. Молярная масса смеси газов
μ =
где m i – масса i -го компонента смеси; ν i – количество вещества i -го компонента смеси, νi = mi / μi; n – число компонентов смеси. Массовая доля i -го компонента смеси газа (в долях или процентах)
ωi = mi / m, где m – масса смеси. Концентрация молекул n =
где N – число молекул, содержащихся в данной системе; ρ – плотность вещества;
V – объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества. Основное уравнение кинетической теории газов
p = 2/3 n ·
где Средняя кинетическая энергия поступательного движения молекулы
где k – постоянная Больцмана. Средняя полная кинетическая энергия молекулы
где i – число степеней свободы молекулы. Зависимость давления газа от концентрации молекул и температуры
p = n · k · T.
Скорости молекул: – средняя квадратичная
– средняя арифметическая
– наиболее вероятная
где m 1 – масса одной молекулы. Относительная скорость молекулы
u = V / Vв,
где V – скорость данной молекулы. Среднее число столкновений молекулы газа за 1 с
где d – эффективный диаметр молекулы газа; n –концентрация молекул газа;
Средняя длина свободного пробега молекул (расстояние, проходимое молекулой газа между двумя последовательными столкновениями)
Удельные теплоемкости газа при постоянном объеме Cv и постоянном давлении Cp определяются по формулам:
Cv =
Связь между удельной c и молярной C теплоемкостями
с = C / μ, С = с · μ.
Уравнение Майера Cp – Cv = R.
Внутренняя энергия идеального газа
U =
Первое начало термодинамики
Q =
где Q – теплота, сообщенная системе (газу);
A – работа, совершенная системой против внешних сил. Работа расширения газа – в общем случае A = – при изобарном процессе A = p (V 2 – V 1);
– при изотермическом процессе
A =
– при адиабатном процессе A = – где γ – показатель адиабаты, γ = CP / CV. Уравнения Пуассона, связывающие параметры идеального газа при адиабатном процессе: p ·V γ = const;
Коэффициент полезного действия (КПД) цикла
η =
где Q 1 – теплота, полученная рабочим телом от нагревателя; Q 2 – теплота, переданная рабочим телом холодильнику. КПД цикла Карно η =
где T 1 и T 2 – температуры нагревателя и холодильника. Разность энтропий двух состояний B и A определяется формулой
Δ S = Типовые задачи
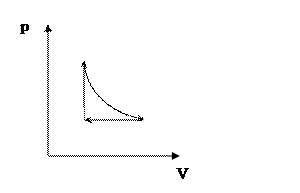
Круговые процессы 3.51 Совершая цикл Карно, газ получил от нагревателя количество теплоты Q1 = 1002 Дж и совершил работу А = 202 Дж. Температура нагревателя Т1 = 375 К. Определить температуру холодильника. 3.52 Газ совершил цикл Карно. Температура нагревателя 480 К, холодильника 260 К. При изотермическом расширении газ совершил работу Ар = 100 Дж. Определить термический КПД η цикла, а также количество теплоты Q2, которое газ отдает холодильнику при изотермическом сжатии. 3.53 Газ совершает цикл Карно. Абсолютная температура нагревателя в n = 3,5 раза выше, чем температура холодильника. Нагреватель передал газу Q = 15 Дж теплоты. Какую работу совершил газ? 3.54 Найти КПД цикла, проводимого с идеальным двухатомным газом и состоящего из двух изотерм с температурами T1 = 390 К и T2 = 290 К и двух изохор с объемами V1 = 20 л и V2 = 10 л. 3.55 Температура пара, поступающего в паровую машину, t1 = 127 ºC; температура в конденсаторе t2 = 27 ºC. Определить теоретически максимальную работу при затрате количества теплоты Q1 = 4,2 кДж. 3.56 1 кмоль кислорода O2 совершает цикл Карно в интервале температур от 27 до 327 ºC. Известно, что отношение максимального за цикл давления pmax к минимальному давлению pmin равно 20. Вычислить: КПД цикла η; работу А, совершаемую газом за цикл. 3.57 Идеальный газ совершает цикл Карно. Температура Т1 нагревателя в 4 раза выше температуры Т2 охладителя. Какую долю ω количества теплоты, получаемого за один цикл от нагревателя, газ отдает 3.58 Идеальный газ совершает цикл Карно. Температура Т1 нагревателя в 3 раза выше температуры Т2 охладителя. Нагреватель передал газу количество теплоты Q1 = 42 кДж. Какую работу А совершил газ? 3.59 Цикл, совершаемый двумя киломолями одноатомного идеального газа, состоит из изотермы, изобары и изохоры (рисунок 2). Известно, что максимальный объем газа в 2 раза больше минимального и изотермический процесс совершается при температуре Т = 400 К. Вычислить работу А и КПД цикла η.
Рисунок 2
3.60 Тепловой двигатель работает по циклу, состоящему из изотермического, изобарного и адиабатного процессов. При изобарном процессе рабочее тело – идеальный газ – нагревается от температуры T1 = 200 К до T2 = 500 К. Определить коэффициент полезного действия данного теплового двигателя и двигателя, работающего по циклу Карно, происходящему между максимальной и минимальной температурами данного цикла.
Энтропия 3.61 Найти изменение энтропии при превращении m = 10 г льда при t1 = –20 ºС в пар при t2 = 100 ºС. 3.62 Найти прирост энтропии при превращении m = 1 г воды при t1 = 0 ºС в пар при t2 = 100 ºC. 3.63 10 г кислорода нагревается от t1 = 50 ºС до t2 = 150 ºС. Найти изменение энтропии, если нагревание происходит: изохорически; изобарически. 3.64 640 г расплавленного свинца при температуре плавления вылили на лед при t = 0 ºС. Найти изменение энтропии при этом процессе. 3.65 Найти изменение энтропии при переходе m = 8 г кислорода от объема V1 = 10 л при температуре t1 = 80 ºC к объему V2 = 40 л при температуре t2 = 300 ºС. 3.66 Найти изменение энтропии при переходе m = 6 г водорода от объема V1 = 20 л под давлением P1 = 1,5 · 105 H/м2 к объему V2 = 60 л под давлением P2 = 1 · 105 H/м2. 3.67 Водород массой m = 6,6 г расширяется изобарически до удвоения объема. Найти изменение энтропии при этом расширении. 3.68 Найти изменение энтропии при изобарическом расширении гелия массой m = 8 г от объема V1 = 10 л до V2 = 25 л. 3.69 Масса m = 10,5 г азота изотермически расширяется от объема 3.70 В результате нагревания m = 22 г азота его абсолютная температура увеличилась в 1,2 раза, а энтропия – на 4,19 Дж/К. При каких условиях производилось нагревание (при постоянном объеме или при постоянном давлении)?
Реальные газы 3.71 Какую температуру имеет масса m = 2 г азота, занимающего объём V = 820 см3 при давлении P = 0,2 МПа? Газ рассматривать как: идеальный; реальный. 3.72 В закрытом сосуде объемом V = 0,5 м3 находится 0,6 кмоль углекислого газа при давлении Р = 3 МПа. Пользуясь уравнением Ван-дер-Ваальса, найти, во сколько раз надо увеличить температуру газа, чтобы давление увеличилось вдвое. 3.73 Найти давление, обусловленное силами взаимодействия молекул, заключенных в 1 кмоле газа при нормальных условиях. Критическая температура и критическое давление этого газа Тк = 417 К и Рк = 7,7 МПа. 3.74 Во сколько раз давление газа больше его критического давления, если известно, что его объем и температура вдвое больше критических значений этих величин. 3.75 1 моль гелия занимает объем V = 237 м3 при температуре 3.76 В сосуде объемом V = 10 л находится m = 0,25 кг азота при температуре t = 27 ºC. Какую часть давления газа составляет давление, обусловленное силами взаимодействия молекул? Какую часть объема сосуда составляет собственный объем молекул? 3.77 0,5 кмоль трехатомного газа адиабатически расширяется в вакуум от V1 = 0,5 м3 до V2 = 3 м3. Температура газа при этом понижается на 12,2 К. Найти постоянную a, входящую в уравнение Ван-дер-Ваальса. 3.78 20 кг азота адиабатически расширяется в вакуум от объема 3.79 Найти коэффициент диффузии гелия при температуре t = 17 ºC и давлении Р = 150 кПа. Эффективный диаметр атома вычислить, считая известными для гелия критические значения Тк и Рк. 3.80 Гелий массой m = 10 г занимает объем V = 100 см3 при давлении Р = 100 МПа. Найти температуру газа, считая его: идеальным; реальным.
Список литературы
1 Трофимова, Т. И. Курс физики: учеб. пособие для втузов / Т. И. Трофимова. – М.: Академия, 2007. – 560 с. 2 Детлаф, А. А. Курс физики / А. А. Детлаф, Б. М. Яворский. – М.: Высш. шк., 2001. – 718 с. 3 Трофимова, Т. И. Курс физики. Задачи и решения: учеб. пособие для втузов / Т. И. Трофимова, А. В. Фирсов.– М.: Академия, 2004. – 592 с. 4 Волькенштейн, B. C. Сборник задач по общему курсу физики / 5 Чертов, А. Г. Задачник по физике / А. Г. Чертов, А. А. Воробьев. – М.: Высш. шк., 1981. – 430 с. 6 Сена, Л. А. Единицы физических величин и их размерность / Л. А. Сена. – М.: Наука, 1988. – 432 с. Приложение А (справочное) Таблица А.1 – Основные физические постоянные (округленные значения)
Таблица А.2 – Некоторые астрономические величины
Таблица А.3 – Плотность твердых тел
Таблица А.4 – Плотность жидкостей
Таблица А.5 – Плотность газов (при нормальных условиях)
Таблица А.6 – Эффективный диаметр молекулы
Таблица А.7 – Удельная теплота парообразования воды
Таблица А.8 – Удельная теплота плавления некоторых твердых тел
Таблица А.9 – Удельная теплоемкость некоторых жидкостей (при 20 ºС)
Таблица А.10 – Относительные атомные массы (округленные значения) Аr
Таблица А.11 – Массы покоя некоторых частиц
Таблица А.12 – Критические параметры и поправки Ван-дер-Ваальса
ФИЗИКА
Методические рекомендации к практическим занятиям для студентов всех специальностей и направлений подготовки очной и заочной форм обучения МЕХАНИКА. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
Могилев 2018 УДК 535 ББК 22.33 Ф 55 Рекомендовано к изданию
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 122; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.97.219 (0.317 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

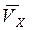 =
= 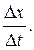
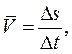
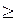 0. Тогда проекция мгновенной скорости на ось x
0. Тогда проекция мгновенной скорости на ось x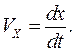
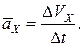

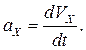
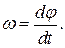
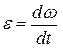 .
.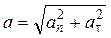 или
или 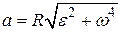 .
.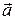 и нормальным
и нормальным 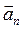 ускорениями
ускорениями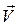 ,
,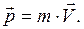
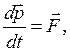
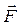 – результирующая сила, действующая на материальную точку.
– результирующая сила, действующая на материальную точку.
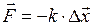 ,
,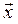 – абсолютная деформация;
– абсолютная деформация;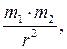
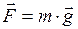 ,
,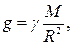
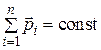 ,
,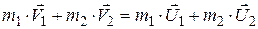 ,
,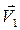 и
и 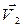 – скорости тел в момент времени, принятый за начальный;
– скорости тел в момент времени, принятый за начальный;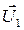 и
и 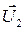 – скорости тех же тел в конечный момент времени.
– скорости тех же тел в конечный момент времени.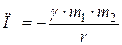 ,
, T = T 2 – T 1.
T = T 2 – T 1.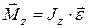 ,
,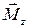 – результирующий момент внешних сил относительно оси z, действующих на тело;
– результирующий момент внешних сил относительно оси z, действующих на тело;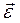 – угловое ускорение;
– угловое ускорение;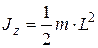 ;
;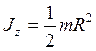 .
.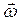 = const,
= const,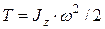
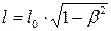 ,
,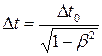 .
.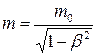 ,
,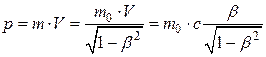 .
.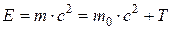 ,
,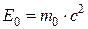 .
.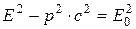 .
.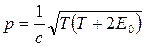 .
.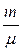 · R · T,
· R · T,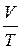 = const,
= const,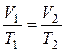 ;
; = const,
= const, ;
; = const или
= const или  ,
,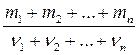 ,
, =
=  ,
, ,
,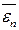 – средняя кинетическая энергия поступательного движения молекулы.
– средняя кинетическая энергия поступательного движения молекулы.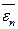 = 3/2 k · T,
= 3/2 k · T,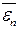 =
=  k · T,
k · T, ;
;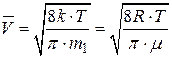 ;
;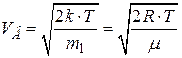 ,
,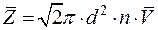 ,
, – средняя арифметическая скорость молекул газа.
– средняя арифметическая скорость молекул газа.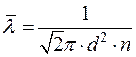 .
.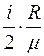 ; Cp =
; Cp = 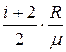 .
.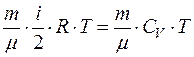 .
. U + A,
U + A,
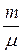 RT ln
RT ln 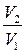 ;
; ,
,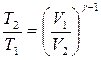 ;
; ;
; 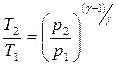 .
.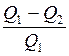 ,
,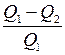 =
=  ,
, .
.