Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы получения наноструктур ZnS
В работе [26] было изучено приготовление нульмерных нанокристаллов ZnS методом осаждения из раствора, и влияние концентрации серы и тринатриевого цитрата на образование наночастиц, используя тринатриевый цитрат (ТНЦ) как поверхностно-активное вещество (ПАВ), которое может в определённых пределах ограничить увеличение размеров нульмерных наночастиц. Na2S (0.1 М) смешивают с ТНЦ (2 М), добавляют к раствору ZnCl2 (происходит реакция ионного обмена), перемешивают до выпадения белого осадка. Осадок промывают в этаноле, потом в деионизированной воде, затем опять в этаноле. Полученный порошок прогревается на воздухе при 600 0C. Далее меняли концентрацию ТНЦ в пределах от 0 до 3 М. Было выявлено, что концентрация ТНЦ значительно влияет на образование нульмерных наноструктур ZnS за счёт поверхностной активности этого вещества, снижения поверхностного напряжения частиц, и ингибирования их агрегации. Наименьшие частицы (от 1.46 до 2.25 нм) были получены в растворе с концентрацией ТНЦ равной 2 М. Пик поглощения полученного вещества составлял 283 нм (УФ диапазон). С помощью спектрометрии были сравнены образцы с цитратом и без него в растворе. Различия оказались незначительными, и это объясняется тем, что при данной концентрации ТНЦ он полностью покрывает наночастицы. Ширина запрещённой зоны полученного вещества ZnS составила (исходя из расчётов, связанных с пиком поглощения) 4.38 эВ. Полученные образцы были изучены с помощью метода дифракции рентгеновских лучей, электронной микроскопией, анализом дисперсии рентгеновского излучения, и УФ-спектрометрии. Источником ионов серы являлся сульфид натрия, концентрация которого менялась, от 0.05 до 1.5 М. Согласно спектроскопическому анализу, самым большим показателем поглощения обладал препарат, приготовленный в растворе с концентрацией сульфида натрия 0.1 М. Средний размер кристаллов в ходе эксперимента менялся от 2.43 (при С (Na2S) = 0,1 М) до 6.91 нм. Ширина запрещённой зоны, как оказалось, для данной наноструктуры в определённом пределе обратно пропорциональна размеру частиц. Для её расчёта использовались два метода: уравнение Брюса и расчёт на основе поглощаемого спектра [27]. Полученный образец, согласно таким расчётам, обладает шириной запрещённой зоны, приблизительно 4.40 – 4.71 эВ.
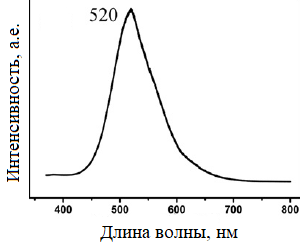
Для одномерных наноструктур оптимально подходит VLS-метод (метод осаждения из паровой фазы) получения наноструктур ZnS на золотой плёнке. В соответствующем эксперименте массивы нанонитей ZnS получали путём нагревания в керамической «лодочке» смеси порошков цинка и сульфида цинка в количественном соотношении 10: 1 до 750 ºС в течении часа, при этом примерно на расстоянии 8 см находилась кремниевая подложка с нанесённым на неё слоем золота, разогретая до 530 ºС на которой осаждался сульфид цинка, образуя массивы наноструктур. Изображения этих структур, полученные с помощью сканирующего электронного микроскопа, представлены на рисунке 9. Спектр поглощения этих наноструктур оказался в зелёном диапазоне видимого спектра (рисунок 10).
a – массив одномерных наноструктур ZnS на керамической подложке, б - массив одномерных наноструктур ZnS на керамической подложке покрытой пленкой золота
Рисунок 9 – Наноструктуры ZnS полученные VLS-методом
Рисунок 10 – Спектр поглощения нанонитей ZnS, полученных VLS-методом
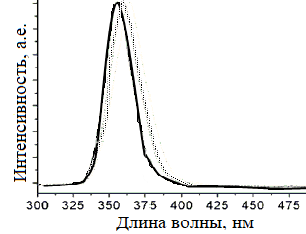
Так же оказалось возможным контролировать оптические и геометрические параметры наноноструктур сульфида цинка с помощью вариации молярных соотношений комплекса 2-меркаптобензотиазола цинка (C7H5S2N) и олеиламина (C18H37N) [28]. В данном случае 2-меркаптобензотиазол цинка используется как прекурсор. Раствор 0.02 моль 2-меркаптобензотиазола цинка смешали с 30 мл этанола и 0.01 моль ацетата цинка (Zn(CH3COO)2), получившуюся смесь нагрели до 60 ºC и удерживали температуру в течение 8 часов. Далее добавили 8 мл олеиламина и 0.58 моль 2-меркаптобензотиазола цинка, после чего выдерживали 7 часов при температуре 270 ºC и затем центрифугировали. Получившиеся наноструктуры сульфида цинка исследовали на предмет спектра поглощения (рисунок 11) и получили их изображения с помощью сканирующего электронного микроскопа высокого разрешения (рисунок 12). В другой работе [29] был описан синтез наноструктур сульфида цинка путём низкотемпературной твердотельной реакции, который обеспечивает простой и надёжный метод контроля размеров и форм наноструктур. Синтезированные наноструктуры ZnS имеют низкую стоимость и не имеют высокой токсичности. Был обеспечен контроль над размерами и формами частиц путём использования ПАВ, а также были оптимизированы оптические свойства наночастиц ZnS.
Рисунок 11 – Спектр поглощения полученных наноструктур ZnS
Рисунок 12 – SEM изображение полученных одномерных наноструктур ZnS
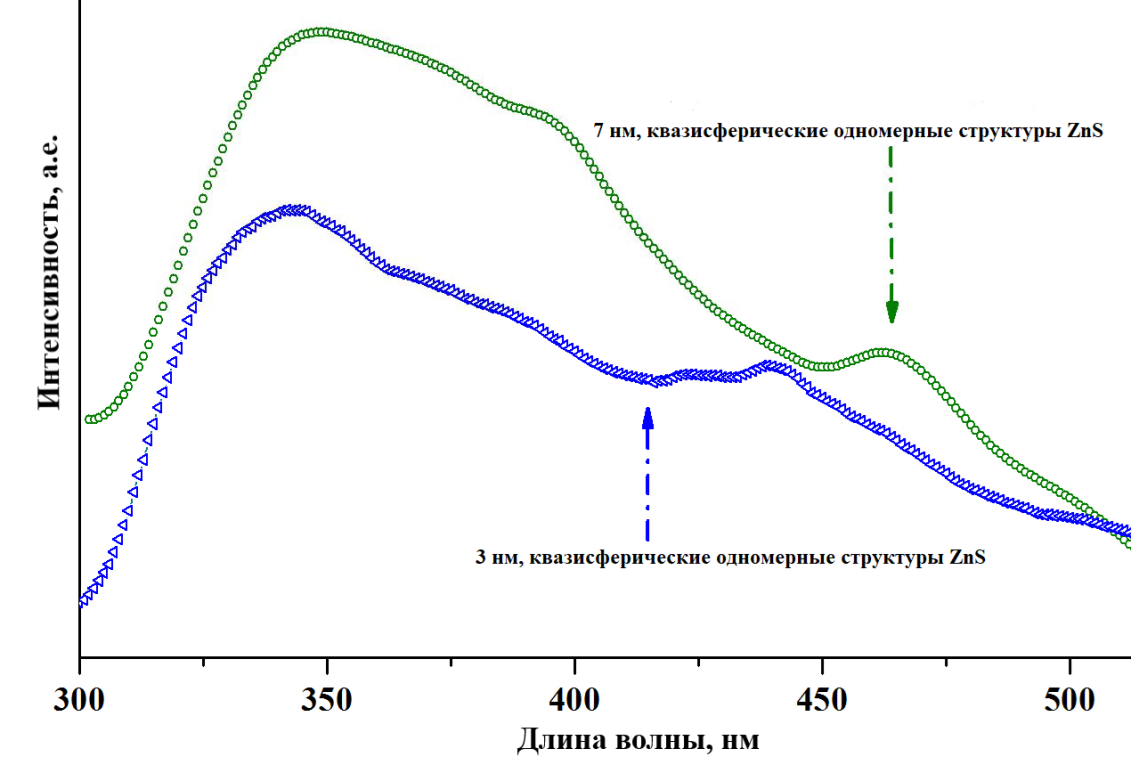
В качестве ПАВ использовались додецилбензолсульфонат (SDBS) натрия и цетилтриметиламмонийбромид (CTAB). Кристаллический ацетат цинка в виде порошка смешали с SDBS и CTAB в пропорции по количеству вещества 5:1 (ацетат: ПАВ), и измельчали смесь 10 минут при комнатной температуре. Затем гидратированный сульфид натрия был добавлен в смесь в количественном соотношении 1:1 к ацетату цинка. Смесь была измельчена в течение 30 минут, очищена центрифугированием до получения дисперсии ZnS частиц в деионизированной воде. Исходя из результатов рентгеноэлектронного спектроскопического метода был сделан вывод, что отношение количеств атомов цинка к количеству атомов серы составляют 1:1.03 и 1:1.05 соответственно. Наночастицы ZnS в первом случае оказались квазисферическими, со средним размером наноструктур от 2.5 до 3.5 нм. Частицы во втором случая оказались игольчатой формы. Некоторые наночастицы оказались волно-подобной формы, содержат большое количество впадин и «дефектов упаковки». Далее были фотолюминесцентные свойства данных структур. В дополнение, рассмотрены было решено рассмотреть зависимость размера наноструктур ZnS от количества ПАВ, и провели аналогичную реакцию с соотношением ПАВ к ацетату цинка 1:10 и получили со средним размером около 7 нм квази-сферической формы. Пик поглощения для исследуемых частиц составил 264 и 259 нм. Расчётные значения ширины запрещённых зон (∆Eg) составили 4.73 эВ и 4.78 эВ, соответственно (рисунок 13) [30].
Рисунок 13 – Зависимость спектра поглощения от формы частиц ZnS
Для нанокристалла квазисферической формы пик эмиссии оказался на длине волны фиолетового спектра (около 342 нм) обусловленный межзонным перемещением электронов. Далее менее значимые пики люминесценции оказались равными 378, 439, 456 нм. Пик эмиссии для данной структуры составил 341 нм (межзонное перемещение). Менее значимые длины волн эмиссии составили 349, 365 и 432 нм, обусловленные внутризонным перемещением. Пик спектра излучения (межзонная эмиссия) наноструктур сместился в «красную» сторону к 349 нм в отличие от 3-х нанометровой структуры, как и остальные пики эмиссии (рисунок 14). Пики эмиссии на длине волны 378 нм и 439 нм объясняется перемещением электронов из зоны проводимости в валентную зону. Эмиссия на длине волны 456 нм объясняется внутризонным перемещением электронов. По сравнению с квазисферическими кристаллами кристаллы иглоподобной формы обладают эмиссией, интенсивность которой больше чем в два раза превышает интенсивность первых. Исходя из указанного выше, был сделан вывод, что эмиссия за счёт межзонного перемещения электронов (наиболее интенсивная) больше зависит от размера частиц, нежели от их формы [31].
Рисунок 14 – Зависимость пика поглощения от размера наноструктуры ZnS Чтобы убедиться в этом, была проанализирована излучательная эмиссия наноструктур ZnS, со средним размером частиц порядка 7 нм.
Также большой интерес вызывают работы, в которых описываются коаксиальные структуры на основе ZnS. В одной из них [32] описан простой двух-шаговый метод, состоящий из гидротермической и реакции ионного обмена. Было выявлено, что коаксиальные структуры ZnO/(CdS)1-X(ZnS)X могут поглощать электромагнитное излучение разных длин волн: от УФ диапазона до видимого зелёного, в зависимости от того, как они были получены. Фотоэлектроды на коаксиальных структурах ZnO/CdS дали неплохие показатели: КПД около 2.093 %, плотность тока короткого замыкания 7.733 мА, напряжение холостого хода 0.536 В. Полупроводниковые солнечные батареи могут быть заменены поверхностями, покрытыми, подобно краске, такими структурами. Эти системы, теоретически, будут обладать рядом преимуществ: простой способ контроля ширины запрещённой зоны с помощью эффекта квантовых размеров, большой КПД около 44 %, и т.д. Меньшие показатели обычных солнечных батарей по большей части обусловлены небольшим количеством квантовых точек на единицу площади, низкой адгезией между полупроводником и фотоанодом, и т.д. [33]. ZnO был выбран как материал для фотоанода благодаря определённым свойствам, таких как ширина запрещённой зоны (3.37 эВ), большой подвижности электронов, большой энергией образования экситонов (квази-частица возбуждения). Поверхностный слой ZnO можно заменить на ZnS (∆Eg = 3.62 эВ) либо CdS (∆Eg = 2.4 эВ), с помощью реакции ионного обмена. Более того, благодаря тому, что связи между Cd, Zn и O, S подобны, и заменяются на более электроотрицательные, соединение между разными слоями будет более плотным. ZnS – массив был выращен на фтор-оксиде олова (FTO), гидротермальным методом [34]. Данная поверхность была вымыта с использованием ультразвука в ацетоне, этаноле, и в деионизированной воде в течение 20 минут. После высушивания в струе азота очищенное FTO поместили в раствор, содержащий 0.6 М ацетата цинка и 0.6 М диэтаноламина, в спирте, процентрифугировали в течение 30 секунд на скорости 2000 оборотов в минуту. Затем отжигали в печи при температуре 400 ºС около получаса, чтобы образовать зародышевый слой для нарастания ZnO. Затем полученную структуру поместили в раствор обьёмом 80 мл, содержащий 0.020 М гексагидрата нитрата цинка, столько же гексаметилнететрамина, и 3.5 мл раствора аммиака (концентрацией 28%). FTO, покрытый зародышами был опущен лицевой стороной вниз и раствор нагрели до 95 ºС, на 12 часов. Наконец, система с массивом нанонитей ZnO промывалась в деионизированной воде некоторое время, чтобы смыть остатки реакции и была просушена при 80 градусах. Затем происходило образование массивов ZnO/ZnS коаксиальных нанопроводов. Для образования данной структуры было решено провести следующую реакцию ионного обмена. Полученная ранее структура была помещена в водный раствор 0,050 М тиоацетамида на 3.5 часа при температуре 90 ºС. После этого полученная система была вымыта в деионизированной воде и высушена при 80 ºC. Полученная система была помещена в водные растворы хлорида кадмия (0.050 М) при температурах 50, 90 и 140 ºС, на 12 часов [34].
Полученная структура была вымыта и высушена на воздухе. Далее, чтобы проанализировать структуру без «сердечника» из ZnO, некоторую часть поместили в 5 % раствор уксусной кислоты на полчаса. Далее создавали непосредственно солнечную ячейку. В качестве отрицательного электрода на предварительно очищенную поверхность FTO нанесли тонкую плёнку из платины путём магнетронного напыления. На рисунке 15 изображена последовательность соответствующих реакций. Массив нанопроводов, как электрод, и платиновую плёнку, как отрицательный электрод, разделили полипропиленовой заслонкой, а внутреннее пространство солнечной ячейки залили жидким электролитом. Активная площадь солнечной ячейки составила 0.15 см2 , включая защитную поверхность. Результаты были следующими: Так как растворимость ZnO на много превышает растворимость ZnS и CdS, структуры на основе ZnO можно использовать как растворимый «шаблон» для создания более устойчивых систем на основе ZnS. При повышении температуры на последнем этапе образования структур ZnO/(CdS)1-X(ZnS)X нанонити становятся толще, а их поверхность – «шершавей». При 140 ºС ионы кадмия полностью заменяют ионы цинка в ZnS (рисунок 16).
Рисунок 15 – Последовательный процесс реакций для получения гетероструктур ZnO/(CdS)1-X(ZnS)X
a – нанонити ZnS вид сверху, b – нанонити ZnS вид сбоку
Рисунок 16 – Изображения синтезированных нанонитей ZnS Ширина запрещённой зоны для сердечника из ZnO составила 3.337 эВ, оболочки из CdS – 2.384 эВ, оболочки из (CdS)1-X(ZnS)X при минимальном количестве кадмия – 3.446 эВ. Таким образом, можно контролировать ширину запрещённой зоны оболочки такой коаксиальной структуры с помощью изменения температуры реакции на завершающем её этапе. Наибольшим током короткого замыкания (7.733 мА∙см2), как и КПД (2.093 %), обладает образец, полученный при реакции ионного обмена при температуре 140 ºC, т.е. ZnO/CdS. Напряжение холостого хода для всех структур оказалось практически одинаковым, от 0.583 В ((CdS)0,12(ZnS)0.88) до 0.536 В (ZnO/CdS) (рисунок 17).
a – полученная (CdS)1-X(ZnS)X система, b – вольт-амперная характеристики (CdS)1-X(ZnS)X системы
Рисунок 17 – Структурное изображение полученной системы и её вольт-амперная характеристика
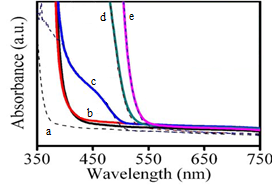
В соответствии с анализом спектров поглощения полученных наноструктур выяснено, что полученные структуры эффективно поглощают электромагнитное излучение с длинами волн примерно от 400 до 530 нм, что соответствует видимому спектру излучения: от фиолетового до зелёного, в зависимости от состава структур, что применимо для солнечных батарей (рисунок 18).
Также оказалось, что возможно получать нанонити ZnS, покрытые слоем углерода [35]. Монокристаллические нанонити сульфида цинка, покрытые углеродом, были получены термическим испарением смеси порошков сульфидов цинка и олова в графитовом тигле. Сердцевина нанонити из ZnS образовывалась каталитической реакцией, из паровой фазы в твёрдую.
a – спектр поглощения гетероперехода ZnS/ZnO, b – спектр поглощения гетероперехода ZnO/(CdS)0.12(ZnS)0.88, c – спектр поглощения гетероперехода ZnO/(CdS)0.45(ZnS)0.55, d – спектр поглощения гетероперехода ZnO/CdS, e – спектр поглощения гетероперехода (CdS)0.45(ZnS)0.55
Рисунок 18 – Спектры поглощения коаксиальных наноструктур ZnS разной концентрации
Даная работы была проведена с целью изучения увеличения устойчивости уже полученных полупроводниковых структур. Устойчивость наноразмерных материалов – один из важнейших факторов использования их в технике [36]. Чтобы сделать нанонитей ZnS устойчивее и практичнее необходимо пассивировать их поверхность. Есть работы, где представлена пассивация поверхности данных структур велась с использованием диоксида кремния, нитрида бора. Был предложен более простой и дешёвый метод. Монокристаллические нанонити сульфида цинка, покрытые углеродом, были синтезированны в верикальной индукционной печи, которая в себя включает плавящуюся кварцевую трубку и нагреваемый индукцией цилиндр, сделанный из высокочистого графита, с термоизолирующим покрытием из углерода, и трубками для подачи, либо откачки углерода. Процесс состоит из двух стадий: сначала, графитовый тигель, содержащий 1 г сульфида цинка и 0.3 г сульфида олова был помещён в центр цилиндра. Далее вся кварцевая трубка была прочищена чистым азотом при давлении порядка 20 Па. Далее печь была быстро нагрета до 1150 ºC на 30 мин, затем до 1300 ºC тоже примерно на 30 минут. После этого печь была охлаждена до комнатной температуры, были обследованы и проанализированы образцы. Выращенные таким образом структуры имеют длину около 100 мкм, с диаметром от 50 – 120 нм. Слой углерода, покрывающий нанонитей, имеет толщину около 2 нм. Было установлено, что на «верхушках» нанонитей осталось олово в значительных количествах (рисунок 19).
a – массив нанонитей ZnS, b – игольчатые нанонити ZnS
Рисунок 19 – Изображение ZnS наноструктур, покрытых углеродом
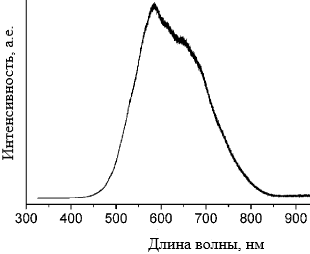
Анализ фотолюминесценции показал, что максимальные её значения для данного вещества проявляются на длинах волн 586 нм и 645 нм. Пик 645 нм – нехарактерный для данного вещества, объясняемый включениями из олова и покрытием из углерода (рисунок 20).
Рисунок 20 – Спектр фотолюминесценции полученной наноструктуры ZnS
Сульфид олова подвергается термическому разложению, в результате чего образуются сера и олово в виде паров. Далее образующийся пар олова перемещается в более холодные участки, и конденсируется на поверхности тигля. Эти маленькие капельки олова «цепляют» молекулы сульфида цинка. Это приводит к образованию сплава Zn – Sn – S. Постепенно этот сплав перенасыщается ZnS, и образуются нанонити. На протяжении второго этапа температура повышается до 1300 ºC. При такой температуре происходит реакция с заменой цинка на углерод. Образуется промежуточное соединение CS2, которое оседает на поверхности нанонитей, разлагается с выделением серы, а оставшийся углерод остаётся на поверхности. Метод был разработан для защиты одномерных наноструктур от коррозии, биоразлагания, окисления, и других воздействий, для более широкого технического применения.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 137; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.66.178 (0.044 с.) |