
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 8. Растворы электролитов
Вариант № 1 Дополните:
1. Электролиты – это ________________________________________________ 2. К сильным электролитам относятся: _________________________________ 3. Кислоты – это ____________________________________________________ 4. Общие свойства оснований обусловлены наличием ___________________, окрашивают индикаторы ___________________, взаимодействуют: ________ 5. Кислые, основные и комплексные соли диссоциируют _________________
Выберите правильный вариант ответа:
6. Диссоциация по трём ступеням возможна в растворе: 1) гидроксида алюминия 3) нитрата алюминия 2) хлорида алюминия 4) ортофосфата калия
7. Наиболее слабым электролитом является: 1) HF 2) HCl 3) HBr 4) HI
8. В качестве катионов только ионы 1) NaOH 2) NaH2PO4 3) H2SO4 4) NaHSO4
9. Уравнение реакции практически осуществимой в водном растворе имеет вид 1) CuSO4 + 2KOH → K2SO4 + Cu(OH)2 2) Fe2(SO4)3 + 6HNO3 → 2Fe(NO3)3 + 3H2SO4 3) NaNO3 + HCl → NaCl + HNO3 4) Ba(NO3)2 + 2NaOH → 2NaNO3 + Ba(OH)2
10. Уравнению реакции Zn (OH)2 + H 2 SO 4 → ZnSO 4 + 2 H 2 O соответствует сокращенное ионное уравнение 1) 2) 3) 4)
11. Сокращенное ионное уравнение 1) Fe(NO3)3 и KOH 3) Na2S и Fe(NO3)2 2) FeSO4 и LiOH 4) Ba(OH)2 и FeCl3 12. При взаимодействии оксида серы (ΙV) с избытком раствора NaOH образуется ___________________ 1) гидросульфат натрия 3) гидросульфит натрия 2) сульфат натрия и вода 4) сульфит натрия и вода Сумма коэффициентов в кратком ионном уравнении равна _______________
13. При взаимодействии ионов 1) темно-синего осадка 3) бурого осадка 2) белого осадка 4) кроваво-красного раствора
Вариант № 2 Дополните:
1. Электролитическая диссоциация – это _______________________________ 2. В растворе сильных электролитов больше частиц _____, но меньше ______ 3. К слабым электролитам относятся: __________________________________ 4. По типу сильного электролита в одну ступень диссоциируют: ___________ 5. Закон разбавления Оствальда устанавливает зависимость между ______ и имеет следующее математическое выражение ___________________________
Выберите правильный вариант ответа:
6. Диссоциация по трём ступеням возможна в растворе: 1) хлорида алюминия 3) нитрата алюминия 2) ортофосфата калия 4) ортофосфорной кислоты
7. К сильным электролитам относятся (несколько вариантов ответа): 1) PbI2 2) H2CO3 3) NaOH 4) Al2(SO4)3
8. В качестве анионов только ионы 1) Cr(OH)2NO3 2) KOH 3) HNO3 4) MgOHCl
9. Уравнение реакции практически осуществимой в водном растворе имеет вид 1) Ba(NO3)2 + K2SO4 → BaSO4 + 2KNO3 2) BaCl2 + 2KOH → Ba(OH)2 + 2KCl 3) ZnCl2 + H2SO4 → ZnSO4 + 2HCl 4) Na2SO4 + 2KOH → K2SO4 + 2NaOH
10. Уравнению реакции CaCO 3 + 2 HCl → CaCl 2 + CO 2 + H 2 O соответствует сокращенное ионное уравнение 1) 2) 3) 4) 11. Сокращенное ионное уравнение 1) H2CO3 и Na2S 3) H3PO4 и K2S 2) HCl и CuS 4) HBr и (NH4)2S
12. При взаимодействии ортофосфорной кислоты с избытком раствора КOH образуется ___________________ 1) ортофосфат калия и вода 3) дигидроортофосфат калия и вода 2) гидроортофосфат калия и вода 4) ортофосфат калия Сумма коэффициентов в кратком ионном уравнении равна _______________ 13. При взаимодействии ионов 1) бурого осадка 3) белого осадка 2) темно-синего осадка 4) кроваво-красного раствора
Вариант № 3 Дополните: 1. Степень электролитической диссоциации – это ________________________ 2. В растворе слабых электролитов больше частиц ________, но меньше ____ 3. Основания – это __________________________________________________ 4. Общие свойства кислот обусловлены наличием ______________________, окрашивают индикаторы _____________, взаимодействуют: ______________
5. С уменьшением концентрации слабого электролита, степень диссоциации его ______________, согласно закона _________________________________
Выберите правильный вариант ответа:
6. Диссоциация по четырем ступеням возможна в растворе
1) ортосиликата калия 3) ортокремниевой кислоты 2) дигидроортосиликата натрия 4) гидросиликата калия 7. К сильным электролитам относятся (несколько вариантов ответа): 1) Ca3(PO4)2 2) NH4OH 3) HI 4) CuSO4
8. В качестве катионов только ионы 1) KHCO3 2) HNO3 3) Na2HPO4 4) KOH
9. Уравнение реакции практически осуществимой в водном растворе имеет вид 1) Al2(SO4)3+ 6HNO3 → 2Al(NO3)3 + 3H2SO4 2) KNO3 + HBr → KBr + HNO3 3) ZnSO4 + K2S → ZnS + K2SO4 4) Ba(NO3)2 + 2KOH → 2KNO3 + Ba(OH)2
10. Уравнению реакции Fe (OH)2 + H 2 SO 4 → FeSO 4 + 2 H 2 O соответствует сокращенное ионное уравнение: 1) 2) 3) 4)
11. Сокращенное ионное уравнение 1) CaCl2 и Na2CO3 3) CaS и CO2 2) Ca(OH)2 и CO2 4) Ca3(PO4)2 и K2CO3
12. При взаимодействии оксида углерода (ΙV) с избытком раствора КOH образуется _________________________ 1) карбонат калия и вода 3) гидрокарбонат калия 2) карбонат калия 4) гидрокарбонат калия и вода Сумма коэффициентов в кратком ионном уравнении равна _______________
13. При взаимодействии ионов 1) черного осадка 3) бурого осадка 2) белого осадка 4) темно-синего осадка Вариант № 4 Дополните:
1. Степень электролитической диссоциации зависит от следующих факторов: __ 2. Соли – это ____. Средние, двойные и смешанные соли диссоциируют ______ 3. Амфотерные основания диссоциируют: 1 – ______________________ 2 – ______________________ 4. Константа диссоциации (Кд) характеризует _________________, для HNO2 имеет следующее математическое выражение __________________________ 5. Слабые многокислотные основания и многоосновные кислоты диссоциируют _____________________________________________________ Выберите правильный вариант ответа: 6. Диссоциация по двум ступеням возможна в растворе 1) угольной кислоты 3) карбоната калия 2) ортофосфата натрия 4) хлорида цинка
7. Наиболее слабым электролитом является 1) HCN 2) Al2(SO4)3 3) Ca(OH)2 4) HCl
8. В качестве анионов только ионы 1) Fe(OH)2Cl 2) NaOH 3) H2SO4 4) (MgOH)2SO4
9. Уравнение реакции практически осуществимой в водном растворе имеет вид: 1) MgSO4 + 2KOH → Mg(OH)2 + K2SO4 2) K2SO4 + Mg(NO3)2 → MgSO4 + 2KNO3 3) FeCl2 + H2SO4 → FeSO4 + 2HCl 4) BaCl2 + 2HNO3 → Ba(NO3)2 + 2HCl
10. Уравнению реакции K 2 CO 3 + CaBr 2 → CaCO 3 + 2 KBr соответствует сокращенное ионное уравнение 1) 2) 3) 4) 11. Сокращенное ионное уравнение 1) CuCl2 и H2O 3) CuO и H2O 2) CuCl2 и NaOH 4) Cu и NaOH
12. При взаимодействии хлорида железа (ΙΙ) с недостатком раствора NaOH образуется ___________________________ 1) гидроксид железа (ΙΙ) и хлорид натрия 2) гидроксохлорид железа (ΙΙ) и хлорид натрия 3) гидроксид железа (ΙΙ) 4) гидроксохлорид железа (ΙΙ) Сумма коэффициентов в кратком ионном уравнении равна _______________
13. При взаимодействии ионов 1) NH3 со специфическим запахом 3) раствор синего цвета 2) черного осадка 4) бурого осадка
ТЕМА 9. ГИДРОЛИЗ СОЛЕЙ Вариант № 1 Дополните: 1. Гидролиз соли – это _______________________________________________
2. Количественная характеристика гидролиза соли – это величина, называемая _________________, обозначается буквой ____________________
3. Гидролиз соли протекает по катиону, если соль образована ____, рН = ___
4. С повышением температуры степень гидролиза (һ) ____________________
5. Гидроксильный показатель – это __________________, его математическое выражение рОН = _________________
6. Раствор гидроксида бария имеет рН = 12. Концентрация основания в растворе при 100 % диссоциации равна ________________________ моль/л
Установите соответствие:
7. между названием соли и уравнением её гидролиза по первой ступени
8. между названием веществ и продуктами их гидролиза
9. между солью и реакцией среды её водного раствора
Выберите правильный вариант ответа: 10. Одним из продуктов гидролиза нитрата железа (ΙΙΙ) по второй ступени является 1) Fe(OH)2NO3 3) FeOH(NO3)2 2) FeOH(NO3) 4) Fe(OH)3
11. Кислая среда образуется при растворении в воде каждой из двух солей 1) MgSO4 и Zn(NO3)2 3) BaCl2 и AlCl3 2) K2S и K3PO4 4) CuCl2 и LiCl
12. Метилоранж желтый при растворении в воде каждой из двух солей 1) K2SO3 и Na3PO4 3) ZnCl2 и CuSO4 2) CaCl2 и FeCl3 4) Mn(NO3)2 и NaCl
13. При взаимодействии водных растворов солей сульфата хрома (ΙΙΙ) и карбоната калия, сумма коэффициентов в кратком ионном уравнении равна 1) 13 2) 15 3) 10 4) 9 14. В уравнении для расчета константы гидролиза хлорида аммония не учитывается значение концентраций
1)
Вариант № 2 Дополните:
1. В результате гидролиза соли образуется электролит ___________________ 2. Степень гидролиза – это ___________________________________________ 3. Гидролиз соли протекает по аниону, если соль образована _____ рН = ______
4. Чем больше Кг соли, тем __________________________________________ 5. рН + рОН = ______________________________________________________ 6. Раствор, в 500 мл которого растворено 1,825 г HCl, имеет рН, равный ____ Установите соответствие: 7. между названием соли и уравнением её гидролиза по первой ступени ______
8. между названием веществ и продуктами их гидролиза
9. между солью и реакцией среды её водного раствора
Выберите правильный вариант ответа: 10. Одним из продуктов гидролиза ортофосфата натрия по второй ступени является 1) NaH2PO4 3) Na2HPO4 2) H3PO4 4) NaHPO4
11. Щелочная среда образуется при растворении в воде каждой из двух солей 1) KNO3 и K3PO4 3) K2S и K3PO4 2) FeSO4 и KCl 4) K2SO4 и CH3COOK
12. Метилоранж красный при растворении в воде каждой из двух солей: 1) Fe(NO3)2 и CuSO4 3) ZnCl2 и Li2CO3 2) Na2SO4 и K2S 4) CrCl3 и KCl
13. При взаимодействии водных растворов солей сульфата алюминия и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна 1) 9 2) 10 3) 13 4) 15
14. В уравнении для расчета константы гидролиза цианида натрия не учитывается значение концентраций 1) Вариант № 3 Дополните:
1. Гидролизу не подвергаются соли, образованные _______________________ 2. Чем больше концентрация соли, тем степень гидролиза ________________ 3. При гидролизе соли среда раствора кислая, значит соль образована ______ 4. Ионное произведение воды – это ____________________________________ 5. Кг соли NH4Cl имеет математическое выражение ______________________ 6. Раствор гидроксида калия имеет рН = 12. Концентрация основания при 100 % диссоциации равна _______________________ моль/л Установите соответствие: 7. между названием соли и уравнением её гидролиза по второй ступени
8. между названием веществ и продуктами их гидролиза
9. между солью и реакцией среды её водного раствора
10. Одним из продуктов гидролиза хлорида алюминия по второй ступени является 1) AlOHCl2 3) Al(OH)2Cl 2) Al(OH)3 4) AlCl3 11. Кислая среда образуется при растворении в воде каждой из двух солей 1) Bi(NO3)3 и FeSO4 3) MgSO4 и K2SO4 2) Na2SiO3 и K2SiO3 4) MnCl2 и CaCl2
12. Фенолфталеин малиновый при растворении в воде каждой из двух солей 1) Na2SO3 и MgSO4 3) K3PO4 и Na2S 2) BaCl2 и ZnCl2 4) Na4SiO4 и CuCl2
13. При взаимодействии водных растворов солей хлорида алюминия и карбоната калия, сумма коэффициентов в кратком ионном уравнении равна 1) 15 2) 13 3) 10 4) 9
14. В уравнении для расчета константы гидролиза сульфида калия по 1-ой ступени не учитывается значение концентраций
1)
Вариант № 4 Дополните:
1. Полному гидролизу подвергаются соли ______________________________ 2. Степень гидролиза зависит от следующих факторов: 1) ________ 2) ______ 3) ________ 4) ______
3. Чем меньше Кд слабого электролита, тем степень гидролиза (һ) __________ 4. Водородный показатель – это ___________, его математическое выражение имеет вид рН = __________________
5. Если
6. Раствор серной кислоты имеет рН = 1. Концентрация H2SO4 в растворе при 100% диссоциации равна_______________ моль/л
Установите соответствие: 7. между названием соли и уравнением её гидролиза по первой ступени
8. между названием веществ и продуктами их гидролиза
9. между солью и реакцией среды её водного раствора
Выберите правильный вариант ответа: 10. Одним из продуктов гидролиза ортосиликата калия по второй ступени является 1) K2H2SiO4 3) KH3SiO4 2) K3HSiO4 4) H4SiO4
11. Кислая среда образуется при растворении в воде каждой из двух солей 1) Fe(NO3)3 и MnSO4 3) K2SO4 и Al2(SO4)3 2) K3PO4 и Na2S 4) BaCl2 и CuCl2
12. Метилоранж желтый при растворении в воде каждой из двух солей 1) Na3PO4 и K2S 3) Na2SiO3 и FeCl3 2) Ba(NO3)2 и AlCl3 4) K2SO3 и K2SO4 13. При взаимодействии водных растворов солей хлорида хрома (ΙΙΙ) и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна 1) 13 2) 10 3) 15 4) 9
14. В уравнении для расчета константы гидролиза ацетата натрия не учитывается значение концентраций 1)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 289; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.193.158 (0.121 с.) |
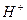 образуются при диссоциации
образуются при диссоциации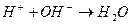
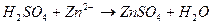
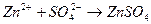
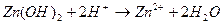
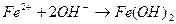 соответствует взаимодействию веществ
соответствует взаимодействию веществ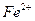 с гексацианоферратом (ΙΙΙ) калия K3[Fe(CN)6] – красной кровяной солью (к.к.с) наблюдается образование ____
с гексацианоферратом (ΙΙΙ) калия K3[Fe(CN)6] – красной кровяной солью (к.к.с) наблюдается образование ____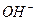 образуются при диссоциации
образуются при диссоциации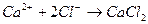
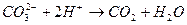
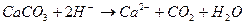
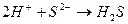 соответствует взаимодействию веществ:
соответствует взаимодействию веществ: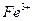 с гексацианоферратом (ΙΙ) калия K4[Fe(CN)6] – желтой кровяной солью (ж.к.с) наблюдается образование _____
с гексацианоферратом (ΙΙ) калия K4[Fe(CN)6] – желтой кровяной солью (ж.к.с) наблюдается образование _____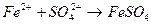
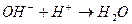
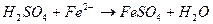
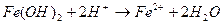
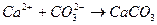 соответствует взаимодействию веществ
соответствует взаимодействию веществ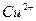 с сероводородом (H2S) наблюдается образование ______________________________
с сероводородом (H2S) наблюдается образование ______________________________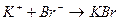
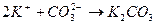
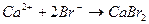
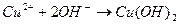 соответствует взаимодействию веществ
соответствует взаимодействию веществ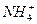 с раствором щелочи при нагревании наблюдается образование ____________________________________________
с раствором щелочи при нагревании наблюдается образование ____________________________________________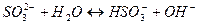
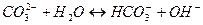
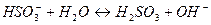
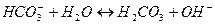
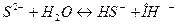
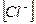 2)
2) 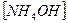 3)
3) 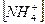 4)
4) 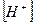
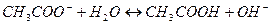

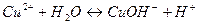
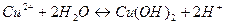
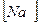 2)
2) 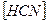 3)
3)  4)
4) 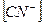
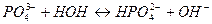
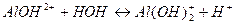
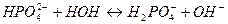
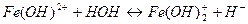
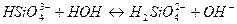
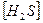 2)
2) 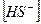 3)
3) 

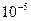 , то
, то 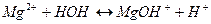
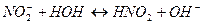
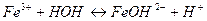
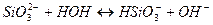
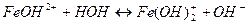
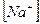 2)
2)  3)
3) 



