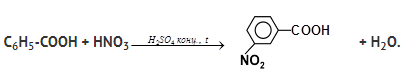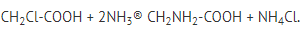Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Названия спиртов (номенклатура ИЮПАК)Стр 1 из 4Следующая ⇒
Названия спиртов (номенклатура ИЮПАК) Спирты – производные углеводородов, в которых один или несколько атомов водорода заменены на функциональную группу -OH (гидроксил): R-OH CH4 метан – СH3OH метиловый спирт СН3-СН3 этан – CH3-CH2OH этиловый спирт Названия спиртов (номенклатура ИЮПАК) Название спирта образуется от названия предельного углеводорода с прибавлением окончания -ол. Например, СH3–OH – метан ол, CH3–CH2–OH – этан ол,
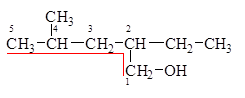
Выбор главной цепи 1. Главная цепь включает гидроксил. 2. Главная цепь нумеруется так, чтобы атом углерода с гидроксилом получил наименьший номер.
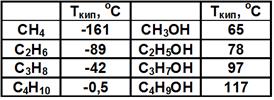
4-метил-2-этилпентанол-1 Одноатомный спирт – спирт, молекула которого содержит одну гидроксильную группу. Пример: СН3-СН2-СН2ОН Многоатомный спирт – спирт, молекула которого содержит две или более гидроксильные группы. Пример: СН2ОН-СН2-СН2ОН Количество гидроксильных групп в молекуле отражается в названии частицами ди-, три-, тетра- и т. д., поставленными перед суффиксом -ол. CH2OH–CHOH–CH2OH пропантриол-1,2,3 (глицерин). Физические свойства спиртов 1. Температуры плавления и кипения спиртов, так же как и углеводородов, увеличиваются с ростом числа атомов углерода в молекуле, но их значения у спиртов намного больше, чем у соответствующих алканов. См. Табл. 1.
Табл. 1. Физические свойства спиртов Причина – водородные связи между молекулами спиртов:
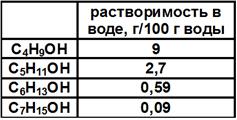
2. Спирты растворимы в воде гораздо лучше углеводородов. Метиловый и этиловый спирты смешиваются с водой в любых соотношениях. С увеличением углеводородного радикала растворимость в воде постепенно уменьшается. Табл. 2.
Табл. 2 Растворимость спиртов в воде. Причина – высокая полярность спиртов, образование водородных связей между молекулами спиртов и воды:
3. Низшие спирты обладают характерным запахом. Например, кошачий запах связан с тем, что в этот запах основным компонентом входит изопропиловый спирт.
Рис. 1. Физические свойства некоторых спиртов. Получение этанола спиртовым брожением глюкозы Протекает только в присутствии ферментов, которые вырабатывают некоторые микроорганизмы, например, дрожжи. C6H12O6 Концентрация этанола в получаемом растворе невелика. Кроме того, помимо этилового спирта образуются и другие органические продукты. Поэтому этанол очищают и концентрируют с помощью перегонки. Рис. 1.
Рис. 1. Получение этанола перегонкой Глюкоза содержится во фруктовых соках. Глюкозу можно получить гидролизом крахмала (из пшеницы, картофеля, целлюлозных опилок): (C6H10O5) n + n H2O Применение этанола Применение этанола представлено на рисунке 2.
Рис. 2. Применение этанола Получение синтетического каучука по методу Лебедева:
Применение фенола · Получение полимеров, в том числе фенолформальдегидных смол:
· Получение искусственных волокон, лекарств, пестицидов. · Антисептик. Реакция со щелочами CH3CH2–O–H+NaOH Реакция не идет! Причина: спирт – более слабая кислота, чем вода, и не может вытеснить воду. Алкоголяты вступают в обратную реакцию: CH3–CH2–ONa+Н2О → CH3–CH2–OH+NaOH CН3СН2ОNa этилат натрия. В чем причина различия активности воды и спиртов? Причина кислотных свойств воды и спиртов – высокая полярность связи О-Н:
Чем больше величина положительного заряда на атоме водорода, тем легче вещество будет отдавать протон и, следовательно, сильнее проявлять кислотные свойства. Чем разветвленнее углеводородный радикал, тем менее полярна связь О-Н и меньше кислотные свойства спирта: НОН > CH3OH > CH3-CH2OH > (CH3)2-CHOH > (CH3)3-COH Включение в молекулу спирта электроотрицательного атома делает увеличение полярности связи О-Н и, как следствие, усиление кислотных свойств: Cl-CH2-CH2OH > CH3OH СН2ОН-СНОН-СН2ОН > ОН-CH2-CH2OH > Cl-CH2-CH2OH Основные свойства спиртов Нуклеофильное замещение Отрицательно заряженный анион кислоты может «вытеснить» молекулу воды из иона алкоксония, заняв ее место:
В результате реакции происходит нуклеофильноезамещение гидроксильной группы спирта на анион кислоты:
Нуклеофильные реакции – реакции, заключающиеся в атаке реагента, имеющего избыточную электронную плотность, на атом углерода с частичным положительным зарядом. Нуклеофильное замещение (SN) отличается от других реакций замещения тем, что атом углерода, по которому происходит атака реагента, несет частичный положительный заряд. Реагент является нуклеофилом (Nu) – частицей с избытком электронной плотности.
Пример нуклеофильного замещения – реакция этерификации Реакция этерификации — реакция образования сложного эфира[2] при взаимодействии спирта и кислоты:
этилсульфат В избытке спирта:
диэтилсульфат При нагревании эти эфиры разлагаются с выделением серной кислоты:
этилен
диэтиловый эфир Т.е. взаимодействие спирта с серной кислотой при нагревании сводится к дегидратации спирта, а серная кислота играет роль катализатора (отбирает воду):
Простые эфиры Простые эфиры – вещества, в которых два углеводородных радикала соединены между собой через атом кислорода: R1–O–R2 1. Простые эфиры называют, перечисляя углеводородные радикалы в алфавитном порядке и добавляя слово «эфир». Если радикалы одинаковы, это обозначают частицей «ди»: СН3-О-С2Н5 метилэтиловый эфир С4Н9-О-СН3 бутилметиловый эфир С4Н9-О-С4Н9 дибутиловый эфир 2. Простые эфиры изомерны спиртам: Например, веществу состава С2Н6О будут соответствовать изомеры: С2Н5ОН этиловый спирт и СН3-О-СН3 диметиловый эфир. 3. Простые эфиры не могут образовывать водородные связи, т.к. в них нет связи Н-О. Поэтому они плохо растворимы в воде, и температуры кипения эфиров намного ниже температур кипения соответствующих спиртов.
Табл. 1 Различие в физических свойствах спиртов и эфиров (см. Табл. 1) из-за того, что в эфирах нет водородной связи. Это также объясняет высокую летучесть этих веществ. Горение Все органические вещества горят. Спирты – не исключение. Рис. 1. С2Н5ОН + 3О2 = 2СО2 + 3Н2О. При горении образуются углекислый газ и вода.
Рис. 1. Спиртовка Ферментативное окисление Этанол окисляется в печени под действием фермента, превращаясь в этаналь – вещество, относящееся к классу альдегидов[1]: Рис. 4.
Обычно организм быстро окисляет этаналь дальше, переводя его с помощью другого фермента в уксусную кислоту:
Если человек злоупотребил алкоголем, то организм не справляется с переработкой этаналя, и наступает отравление, называемое похмельем (Рис. 2).
Рис. 2. Похмелье Уксусная кислота
В молекуле уксусной кислоты есть метильная группа, остаток насыщенного углеводорода – метана. Поэтому уксусная кислота (и другие предельные кислоты) будет вступать в характерные для алканов реакции радикального замещения, например: СН3СOOH + Сl2 1. Непредельные карбоновые кислоты вступают в реакции электрофильного присоединения по кратным связям: СН3-(СН2)7-СН=СН-(СН2)7-СООН + Br2 ® СН3-(СН2)7-СНBr-СНBr-(СН2)7-СООН. 2. Карбоновые кислоты, молекула которых содержит бензольное кольцо, вступают в реакции электрофильного замещения в ароматическом ядре. При этом карбоксильная группа – СООН затрудняет реакцию и ориентирует входящую группу в мета- положение:
3. Атомы галогенов или гидроксогруппы, входящие в состав радикала, могут вступать в реакции нуклеофильного замещения:
Обучающее видео: https://youtu.be/kFPnnHk9lxM https://youtu.be/PdmRp01Wa0M
Домашнее задание: Изучить § 55, 56, выполнить тестовые задания после §
Названия спиртов (номенклатура ИЮПАК) Спирты – производные углеводородов, в которых один или несколько атомов водорода заменены на функциональную группу -OH (гидроксил): R-OH CH4 метан – СH3OH метиловый спирт СН3-СН3 этан – CH3-CH2OH этиловый спирт
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 124; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.94.187 (0.029 с.) |


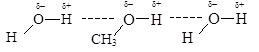

 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
 n C6H12O6
n C6H12O6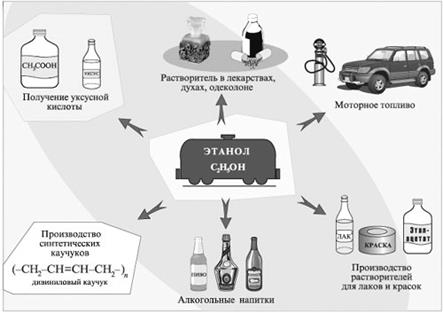
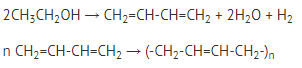

 CH3CH2–O–Na+H2O
CH3CH2–O–Na+H2O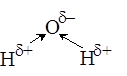

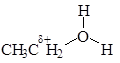 + Cl- → CH3CH2 Cl + H2O
+ Cl- → CH3CH2 Cl + H2O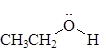 + HCl → CH3CH2 Cl + H2O
+ HCl → CH3CH2 Cl + H2O
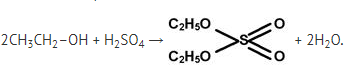



 Но:
Но: 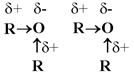



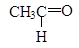
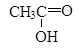

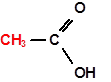

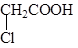 + HCl
+ HCl