
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 8. Методы спектрального и оптического анализаСтр 1 из 14Следующая ⇒
Оптический спектральный анализ: видимая и УФ-спектроскопия поглощения Эмиссионная спектроскопия
В основе эмиссионного спектрального анализа лежит получение и изучение спектров испускания (эмиссионных). Это означает, что в эмиссионной спектроскопии выполняют исследование света, излучаемого веществом (чаще всего – атомами) при его возбуждении в плазме электрического разряда или в пламени газовой горелки (пламенная фотометрия). Чувствительность метода очень высока – до ~ Вещество, помещенное в электрический разряд или в пламя горелки, чаще всего претерпевает термический распад на отдельные атомы – процесс атомизации. Дальнейшее энергетическое возбуждение атомов в дуге, искре или пламени приводит к возрастанию его электронной энергии и переходу из основного (невозбужденного) состояния в возбужденное. Время жизни возбужденных атомов невелико – порядка Качественное определение основано на индивидуальности эмиссионных спектров отдельных элементов, что позволяет проводить их идентификацию путем измерения длин волн отдельных полос. Полученные значения
Рисунок 8.6. Внешний вид спектропроектора ПС-18. 1 – защитная шторка; 2 – предметный столик для фотопластинки; 3 – объектив; 4 – винт настройки резкости; 5 – манипулятор для перемещения пластинки по горизонтали и вертикали для выбора нужной области спектра.
Иногда используют визуальный анализ с помощью устройства, называемого стилоскопом (рисунок 8.7), работающего в 2-х режимах: дуга переменного тока или низковольтная искра.
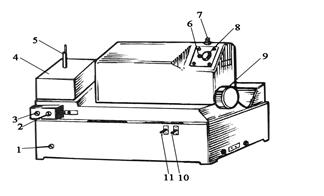
Рисунок 8.7. Внешний вид стилоскопа СЛ-11 1 – рукоятка переключения режимов «дуга» или «искра»; 2 и 3 – регуляторы межэлектродного пространства; 4 – стол с держателем верхнего и нижнего электродов; 5 – верхний электрод сравнения или испытуемый образец; 6 – глазок со шкалой для оценки процента пропускания клина; 7 – барабан для ввода в поле зрения узкой полоски клина; 8 – окуляр контроля выбора нужной области спектра; 9 – барабан со шкалой для ввода нужной области спектра; 10 и 11 – тумблеры для поджига дуги или искры.
Количественный анализ осуществляют путем сравнения интенсивности полос в полученном спектре с интенсивностью аналогичных пиков в спектре эталона. Зависимость интенсивности спектральной линии от концентрации элемента в пробе имеет сложный характер. Однако при постоянном значении энергии возбуждения в ограниченном интервале концентраций она подчиняется эмпирическому уравнению Б. В. Ломакина.
где I – интенсивность спектральной линии; а – некоторая постоянная, объединяющая свойства линии (искровая; дуговая; узкая или широкая); условия возбуждения (скорость испарения и скорость диффузии), другие факторы; с – концентрация элемента в пробе; b – коэффициент самопоглощения. Чтобы свести влияние различных факторов на свойства спектра к минимуму, количественные определения выполняют по относительной интенсивности линии, которая практически не зависит от условий ее возбуждения. Под относительной интенсивностью линии понимают отношение ее интенсивности в спектре к интенсивности линии сравнения, принадлежащей элементу, содержание которого в пробах практически не изменяется. В качестве такого элемента чаще всего выбирают элемент основы. Иногда такой элемент вносят в пробу специально (внутренний стандарт). Расчет выполняют по уравнению (8.2):
где I В узком диапазоне для малых концентраций с можно считать, что интенсивность излучения линейно зависит от концентрации определяемого компонента. I = ac (8.3) Расчет по формуле (8.3) значительно упрощается, как и построение градуировочного графика. Такой зависимостью обычно пользуются при выполнении анализа на пламенном фотометре. Пламенная фотометрия применяется для открытия элементов в 2-х вариантах: пламенно-эмиссионный анализ и атомно-абсорбционный (пламенно-абсорбционный) анализ. В первую очередь, это анализ щелочных и щелочноземельных металлов: Li, Na, K, Ca. Используя специальные светофильтры дополнительно можно анализировать состав на содержание таких элементов, как Sr, Rb, Cs, Ba, B, Cr, Mn и Mg. Так как число возбужденных атомов с ростом температуры пламени увеличивается, то чаще используют не индивидуальные газы, а газовые смеси. Это такие, как смесь воздуха и светильного газа (~1840 Пламенный эмиссионный анализ выполняют на установке, схема которой показана на рисунке 8.8. В пламя горелки вносится анализируемый раствор в виде аэрозоля. Частицы вещества раствора атомизируются при высокой температуре. Так при анализе щелочных металлов применяют смесь воздуха с пропаном или бутаном (1700 – 1900
Рисунок 8.8. Схема эмиссионного пламенного фотометра. 1 – анализируемый раствор; 2 – распылитель; 3 – пламя горелки; 4 – светофильтр или монохроматор; 5 – фотоэлемент; 6 – гальванометр для измерения фототока.
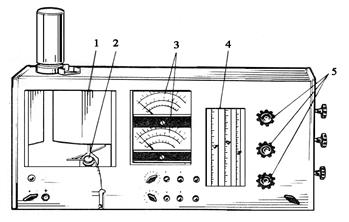
С помощью фотоэлемента или монохроматора выделяют линию с необходимой длиной волны и выполняют измерение ее интенсивности. Например, для калия при 769,9 нм; лития – 678,8; кальция – 622; натрия – 589,9 и магния – 384 нм. Расчет содержания выполняют по градуировочной характеристике. Внешний вид пламенного фотометра показан на рисунке 8.9.
Рисунок 8.9. Вид эмиссионного пламенного фотометра «Флафо-4» 1 – камера сгорания; 2 – устройство для забора и распыления исследуемого раствора; 3 – миллиамперметры; 4 – расходомеры; 5 – краны, регулирующие подачу воздуха и газов.
В атомно-абсорбционной пламенной фотометрии атомизацию осуществляют в специальных печах или горелках куда вносится анализируемый раствор в виде аэрозоля. Через полученную плазму (пламя + возбужденные атомы раствора) пропускают луч света от источника возбуждения. В качестве источников возбуждения применяют разрядные лампы с полым катодом, при работе которых образуется светящаяся плазма, содержащая частоты резонансного перехода открываемого элемента. При прохождении такого излучения через пламя соответствующими элементами поглощаются только резонансные частоты, за счет чего уменьшается общая интенсивность исходного излучения.
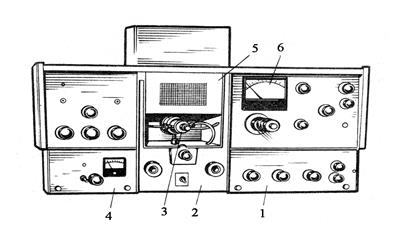
В ходе анализа интенсивность резонансного излучения измеряют дважды: до распыления анализируемой смеси и в момент ее распыления в атомизаторе. Разность этих показаний служит мерой абсорбции и позволяет рассчитать концентрацию измеряемого элемента. На практике используют атомно-абсорбционные спектрофотометры марки «Сатурн», вид которого показан на рисунке 8.10 с чувствительностью определения 0,01 – 0,5 мкг/мл, а также приборы фирмы «Цейс» AAS–1; AAS–2 и другие.
Рисунок 8.10. Вид атомно-абсорбционного спектрофотометра «Сатурн». 1 – спектральный блок; 2 – блок подготовки газов; 3 – распылитель; 4 – блок стабилизированного напряжения; 5 – камера сгорания; 6 – миллиамперметр.
Ненасыщенные углеводороды. Здесь возможно несколько видов структур: с изолированными двойными связями; с алкильными заместителями; циклические и ацетиленовые производные. а) Углеводороды с изолированными двойными связями характеризуются интенсивной полосой, отвечающей переходу б) Углеводороды с алкильными заместителями у этиленовых углеродных атомов характеризуются относительно сильным поглощением в интервале 175 – 200 нм. в) Спектры циклических непредельных углеводородов аналогичны спектрам алкенов. Так циклогексен характеризуется полосой поглощения, имеющей максимум при 183 нм. г) Ацетиленовые углеводороды с изолированной связью (
Таблица 8.3. Положение полосы поглощения в УФ-спектрах некоторых представителей ацетиленового ряда.
д) Сопряжение двойных связей приводит к смещению полосы поглощения в полиенах в длинноволновую область (батохромный сдвиг). Одновременно с этим меняется и вид полосы, на которой четко проявляется колебательная структура. Замена Ароматические углеводороды. Типичным представителем таких соединений является бензол и его производные. Они имеют слабую полосу поглощения из-за запрета по симметрии в области 230 – 260 нм с четко выраженной колебательной структурой (рисунок 8.11). Влияние заместителей на вид спектра определяется не только типом заместителя, но и их количеством, наличия сопряжения с бензольным кольцом. Так алкильные заместители и галогены приводят к небольшому росту интенсивности полос при 200 и 260 нм.
Рисунок 8.11 УФ-спектр поглощения бензола
Полярные заместители, имеющие гетероатом с неподеленной электронной парой, типа ОН, OR,
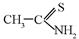
Карбонильные соединения В группе карбонильных соединений рассматриваются спектры альдегидов, кетонов, карбоновых кислот и их эфиров, ангидридов и хлорангидридов, а также амидов. Общим для этих соединений является наличие гетероатома, соединенного кратной связью с углеродом. Поглощение в спектре УФ таких соединений обусловлено переходом n Ø интенсивность полосы поглощения, отвечающей связям С=О и C=N – невысока; Ø чем выше полярность растворителя, тем сильнее гипсохромный сдвиг; Ø в кислой среде влияние неподеленной электронной пары гетероатома блокируется, что приводит к исчезновению поглощения для перехода n Ø из всех характеристических полос данное поглощение в спектре самое длинноволновое. а) Насыщенные карбонильные соединения. Альдегиды и кетоны имеют три полосы в спектре поглощения. Две из них расположены в интервалах 170 – 200 и 150 – 170 нм, полоса, отвечающая переходу n Таблица 8.4 Влияние замещения протона в альдегидной группе на положение полосы поглощения в УФ-спектре.
При расчете максимума полосы поглощения в спектрах альдегидов и кетонов по инкрементным уравнениям, за основу берут максимум полосы поглощения 2,4-динитрофенилгидрозонов
в котором, 7 – инкремент алкильного заместителя; А – число алкильных заместителей; 17 – инкремент 1-й сопряженной двойной связи; 9 – инкремент последующих двойных связей; В – число последующих двойных связей за вычетом первой. б) Непредельные карбонильные соединения Для таких соединений характерно сопряжение кратных связей с карбонильной группой, которое приводит к смещению полос поглощения относящихся к переходам
Таблица 8.5 Влияние полярности растворителя на положение полос поглощения в УФ-спектре оксида мезитила (СН
в) Дикарбонильные соединения. Вид спектра во многом зависит от расстояния между функциональными группами. Если расстояние между группами С=О существенно (более 1-го углеродного атома), то они рассматриваются как одиночные ( Для Для
Рисунок 8.12. УФ-спектр диацетила (
Таблица 8.6. Структура и значение максимума полосы поглощения карбонильных и, соответствующих им, тиокарбонильных соединений.
5. Тиокарбонильные соединения. Сульфоны алифатического ряда не имеют собственных полос поглощения выше 180 нм. Сульфоксиды характеризуются широкой полосой средней интенсивности около 210 нм. Их спектры подобны карбонильным соединениям, но максимумы сильно смещены в красную область (таблица 8.6).
Углеводороды. Циклоалканы. Замыкание углеродной цепочки в кольцо с образованием ненапряженного цикла существенно не сказывается на положении колебаний метиленовых групп. С увеличением напряжения происходит незначительное смещение в основном частот деформационных колебаний (см. рисунок 8.4).
Рисунок 8.23. Вид ИК-спектров изомеров гексана. а – н -гексан; б – 2-метилпентан.
Непредельные углеводороды Алкены В спектрах алкенов появляется полоса в области 1680 – 1640 см Сопряжение двойных связей приводит к появлению 2-х полос поглощения в области 1650 - 1600 см 1.3.2. Алкины. Наличие тройной связи в углеводородной цепочке проявляется характерным поглощением в области 2300 – 2100 см
Эфиры. Простые эфиры – это органические соединения с общей формулой ROR, содержащие связи типа С–О–С. Радикал R – может быть как алифатическим, так и ароматическим. Валентные колебания эфирной группы существенно зависят от структуры эфира и типа радикала. Для алициклических эфиров она расположена в области 1150 – 1060 см
Азотсодержащие соединения Азот может связывать различное число протонов, непосредственно присоединяться к атому углерода, образовывать не только одинарные, но и двойные и тройные связи. Колебания групп, содержащих атом азота, как правило, характеристичны. Это амины, имины, нитро-, нитрозо-, азо- и диазогруппы, нитрильная группа, а также ароматические соединения, содержащие атомы азота. Рассмотрим особенности ИК-спектров азотсодержащих соединения на примере аминов и нитросоединений.
Амины и амиды Основные полосы поглощения аминов (кроме третичных) относятся к колебаниям связей N – H, которые проявляются в областях 3500 – 3000 см Гидроксогруппа усложняет интерпретацию полос аминов, так как появление водородной связи повышает частоту деформационных колебаний. Первичные амины имеют широкую сильную полосу деформационных колебаний при 900 – 650 см
Рисунок 8.29 ИК-спектр втор -бутиламина.
Амиды характеризуются наличием структурной группировки (O=C–N), как например в ROCNH
Нитросоединения. Группа NO Нитрильные гуппы. Валентные колебания связи С
Серосодержащие соединения По ИК-спектрам можно идентифицировать соединения, содержащие связи SO В спектрах простых меркаптанов имеется четкая полоса в интервале 2600 – 2550 см Сульфоксиды определяются по интенсивному поглощению, относящемуся к характеристическим колебаниям $= O в области 1060 – 1040 см Сульфоны имеют характеристичные колебания в интервалах 1160 – 1120 см Сульфокислоты и их соли определяются по симметричным и антисимметричным валентным группы SO
Фотоколориметрия. Фотоколориметрический анализ – один из наиболее широко применяемых оптических методов определения содержания вещества, базирующийся на измерении оптической плотности (абсорбционности) окрашенных сред. Под фотоколориметрией понимают метод анализа основанный на концентрационной зависимости оптической плотности при избирательном поглощении монохроматического света окрашенными средами. Его используют при определении содержания большого числа ионов металлов, образующих интенсивно окрашенные растворимые комплексы, некоторых неметаллов, а также полимерных пленок и стекол. Метод обладает высокой чувствительностью и позволяет работать с сильно разбавленными растворами, содержащими микрограммы вещества. Благодаря низкой концентрации растворов, градуировочные характеристики имеют высокую линейность. Отклонение от линейности наблюдается в сильно рассеивающих или преломляющих средах, поэтому большинство коллоидных растворов нельзя анализировать данным способом. Аналогичная ситуация возможна и в растворах высокой концентрации склонных к образованию макромолекул за счет процесса ассоциации. С помощью фотоколориметрии можно снимать кинетические кривые. В этом случае выполняют либо фотометрическое титрование, либо хронометрический анализ с получением кривой зависимости изменения оптической плотности от времени выдержки (косвенная фотоколориметрия).
Требования к веществам и растворам в фотоколориметрии. Так как фотоколориметрия (фотометрия) основана на избирательном поглощении света, то необходимо максимально исключить потери энергии на рассеяние и люминесценцию, а преломление света при изменении концентрации должно оставаться постоянным. Из этих условий вытекают следующие требования к фотометрируемым растворам (веществам): Ø высокое избирательное поглощение, т. е. растворы должны быть интенсивно окрашены; Ø низкая (порядка мкг) концентрация вещества; Ø низкое преломление и рассеяние света во всем измеряемом диапазоне концентраций; Ø высокая прозрачность растворов и отсутствие рассеивающих ассоциатов, коллоидных частиц, что реализуется в истинных растворах или близких к ним по свойствам; Ø устойчивость к воздействию излучения: отсутствие фотохимических реакций; Ø устойчивость к воздействию иных внешних факторов; отсутствие окисления, испарения или расслоения растворов в ходе анализа.
Рефрактометрический анализ.
Рефрактометрия – это один из методов оптического анализа, широко применяемый в аналитической практике для определения содержания различных органических веществ. Кроме того, по данным рефрактометрических измерений можно рассчитывать такие характеристики веществ, как молярную рефракцию R и относительную диэлектрическую проницаемость прозрачных полимерных материалов. Метод рефрактометрии основан на измерении величины показателя преломления света. Взаимосвязь показателя преломления света с концентрацией вещества используется для быстрого определения содержания сахара или белков в водных растворах. К достоинствам метода следует отнести: Ø простоту измерения и экспрессность; Ø высокую воспроизводимость результатов измерения; Ø использование относительно малых объемов раствора, вплоть до нескольких капель; Ø возможность применения естественного освещения; К недостаткам этого метода следует отнести достаточно высокую концентрацию измеряемого раствора (0,1 – 10 моль/л), так как изменение показателя преломления должно быть значимым даже при незначительном изменении концентрации. Для анализа не подходят интенсивно окрашенные среды, погрешность измерения которых значительно выше, чем прозрачных. Для окрашенных растворов иногда приходится применять специальные приемы измерения. Приведем терминологию, применяемую в рефрактометрическом анализе. Ø дисперсия света – зависимость показателя преломления света n от длины волны; Ø преломление света – это изменение направления луча света при его переходе из одной среды в другую, отличающуюся от первой по плотности вещества; Ø показатель преломления – параметр, характеризующий способность вещества преломлять свет; Ø абсолютный показатель преломления света N – это отношение скорости света в вакууме к скорости света в данном веществе: N = Ø относительный показатель преломления света или просто показатель преломления n – это отношение скорости света в воздухе к скорости света в данном веществе: n = Ø удельная рефракция света r – коэффициент пропорциональности функции связи между показателем преломления среды и ее плотностью; Ø молярная рефракция R – произведение удельной рефракции r и молярной массы вещества М.
8.5.1 Физические основы рефрактометрии. Преломление света описывается законами классической оптики. Согласно этим представлениям падающий и преломленный лучи находятся в одной плоскости с перпендикуляром, проведенным в точку падения. Пусть плотность первой среды
Рисун ок 8.36 Ход лучей (преломлении света) в средах, отличающихся по плотности:
Эта закономерность выражается законом преломления света Снеллиуса или законом синусов: показатель преломления света второй среды относительно первой Аналогичное выражение можно записать и для абсолютных показателей преломления
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 107; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.131.168 (0.194 с.) |
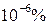 .
.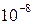 с. Затем атом начинает терять избыточную энергию, в том числе и в виде излучения (эмиссии), переходя либо на исходный основной уровень (резонансное излучение), либо в новое устойчивое состояние с более высокой энергией. Таких состояний и уровней в атоме множество, поэтому эмиссионные спектры состоят из набора большого числа (нескольких сотен, а то и тысяч) линий (рисунок 8.4). В тоже время, сочетание энергетических уровней специфично для каждого атома, следовательно, и их спектры также специфичны, как по набору полос, так и по их относительной интенсивности. По положению и относительной интенсивности отдельных пиков выполняют как качественный, так и полуколичественный анализ состава.
с. Затем атом начинает терять избыточную энергию, в том числе и в виде излучения (эмиссии), переходя либо на исходный основной уровень (резонансное излучение), либо в новое устойчивое состояние с более высокой энергией. Таких состояний и уровней в атоме множество, поэтому эмиссионные спектры состоят из набора большого числа (нескольких сотен, а то и тысяч) линий (рисунок 8.4). В тоже время, сочетание энергетических уровней специфично для каждого атома, следовательно, и их спектры также специфичны, как по набору полос, так и по их относительной интенсивности. По положению и относительной интенсивности отдельных пиков выполняют как качественный, так и полуколичественный анализ состава. и внешний вид спектра сравнивают с эталонными спектрами элементов в атласе или специальных таблицах. Для этого спектры излучения данного вещества и эталонного (например, железа) фотографируют на фотопленку или на фотопластинку, а затем рассматривают через специальный микроскоп (кампаратор) или на спектропроекторе (рисунок 8.6), позволяющего увеличивать выбранный участок спектра до 20-ти раз.
и внешний вид спектра сравнивают с эталонными спектрами элементов в атласе или специальных таблицах. Для этого спектры излучения данного вещества и эталонного (например, железа) фотографируют на фотопленку или на фотопластинку, а затем рассматривают через специальный микроскоп (кампаратор) или на спектропроекторе (рисунок 8.6), позволяющего увеличивать выбранный участок спектра до 20-ти раз.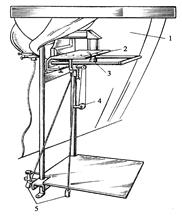
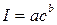 (8.1)
(8.1)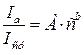 (8.2)
(8.2)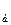 и I
и I 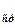 – интенсивности линий анализируемого компонента и стандарта (основы) соответственно; с – концентрация; А и b – эмпирические константы, учитывающие условия получения спектра.
– интенсивности линий анализируемого компонента и стандарта (основы) соответственно; с – концентрация; А и b – эмпирические константы, учитывающие условия получения спектра.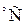 ), ацетиленовые смеси с воздухом, кислородом или водородом (~2955
), ацетиленовые смеси с воздухом, кислородом или водородом (~2955 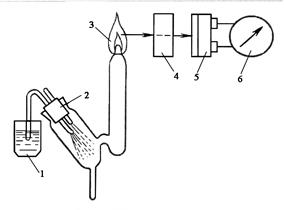
 расположенной при 165 – 200 нм.
расположенной при 165 – 200 нм. ) также имеют поглощение в интервале длин волн 170 – 200 нм. В таблице 8.3 приведены некоторые представители ацетиленового ряда.
) также имеют поглощение в интервале длин волн 170 – 200 нм. В таблице 8.3 приведены некоторые представители ацетиленового ряда.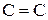 в полиенах на
в полиенах на 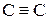 сопровождается только снижением интенсивности полосы поглощения, а не ее расположения.
сопровождается только снижением интенсивности полосы поглощения, а не ее расположения.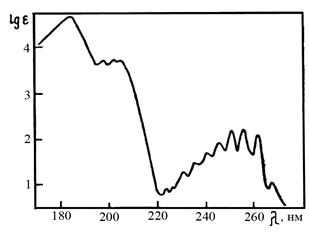
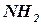 и
и  вызывают значительный сдвиг бензольных полос в длинноволновую область и росту их интенсивности, тогда как колебательная структура – уменьшается, вплоть до полного исчезновения.
вызывают значительный сдвиг бензольных полос в длинноволновую область и росту их интенсивности, тогда как колебательная структура – уменьшается, вплоть до полного исчезновения.
 , для которого характерно:
, для которого характерно: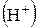 альдегидной группы на OR;
альдегидной группы на OR;  , нм
, нм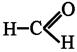
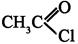


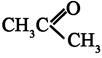
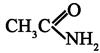
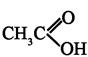
 -ненасыщенные альдегиды и кетоны имеют интенсивную полосу поглощения для перехода
-ненасыщенные альдегиды и кетоны имеют интенсивную полосу поглощения для перехода 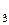 СОСНС(СН
СОСНС(СН 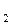 .
.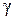 или
или 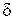 -соединения).
-соединения).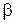 -карбонильных соединений со структурой аналогичной, представленной на рисунке 8.12(а), возможно образование енольной формы (рисунок 8.12-б). Такое превращение приводит к перераспределению полос поглощения, а также их положения в спектре в соответствии с равновесным соотношением обоих форм.
-карбонильных соединений со структурой аналогичной, представленной на рисунке 8.12(а), возможно образование енольной формы (рисунок 8.12-б). Такое превращение приводит к перераспределению полос поглощения, а также их положения в спектре в соответствии с равновесным соотношением обоих форм.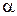 -дикарбонильных соединений характерно наличие в спектре двух полос поглощения низкой интенсивности, как это видно на примере спектра диацетила в гептане (рисунок 8.12).
-дикарбонильных соединений характерно наличие в спектре двух полос поглощения низкой интенсивности, как это видно на примере спектра диацетила в гептане (рисунок 8.12).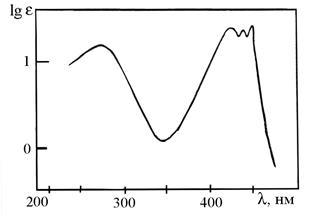
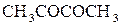 ) в гептане.
) в гептане. ;
;


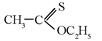
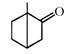


 , характеризующая колебания связи С=С, однако интенсивность ее относительна мала. Она не является чисто валентной, так как ее растяжение приводит к изменению валентных углов в Н–С=С В центросимметричных этиленовых соединениях эта полоса вообще не проявляется. С увеличением числа заместителей частота колебаний связи С=С несколько повышается, причем для транс -изомеров частота полосы выше, а ее интенсивность ниже, чем у цис -изомеров.
, характеризующая колебания связи С=С, однако интенсивность ее относительна мала. Она не является чисто валентной, так как ее растяжение приводит к изменению валентных углов в Н–С=С В центросимметричных этиленовых соединениях эта полоса вообще не проявляется. С увеличением числа заместителей частота колебаний связи С=С несколько повышается, причем для транс -изомеров частота полосы выше, а ее интенсивность ниже, чем у цис -изомеров. (С
(С  С) убывает при ее смещении от края к центру углеродной цепочки.
С) убывает при ее смещении от края к центру углеродной цепочки. чувствительна к образованию водородных связей и в первичных аминах – двойная. Валентные колебания связи C – N проявляются ниже 1200 см
чувствительна к образованию водородных связей и в первичных аминах – двойная. Валентные колебания связи C – N проявляются ниже 1200 см 

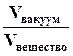 ; (8.15)
; (8.15)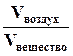 ; (8.16)
; (8.16) меньше плотности второй среды
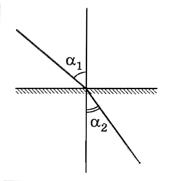
меньше плотности второй среды  . Ход лучей в этом случае показан на рисунке 8.36, где угол падения
. Ход лучей в этом случае показан на рисунке 8.36, где угол падения 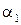 больше угла преломления
больше угла преломления 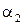 .
.
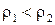 .
.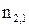 равен отношению синусов углов падающего и преломленного луча.
равен отношению синусов углов падающего и преломленного луча.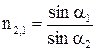 (8.17)
(8.17) и
и  , тогда из закона синусов следует, что:
, тогда из закона синусов следует, что: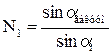 и
и 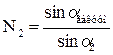 (8.18)
(8.18)


