
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рассчитать концентрацию ионов водорода в 0.1 М растворе формиата аммония. ⇐ ПредыдущаяСтр 4 из 4
Ион аммония является слабой кислотой с Проведем расчет по полной формуле:
Очевидно, что и по приближенной формуле мы получим 3,15 · 10-7. Поскольку гидролиз соли, образованной слабой кислотой и слабым основанием, протекает почти полностью, ионных форм в таком растворе практически нет, и коэффициент активности иона водорода можно принять равным единице. Рассчитать [ H+] в растворах амфолитов: 1) 10-1М раствор гидрокарбоната натрия, 2) 10-2М раствор гидросульфита натрия, 3) 10-3М раствор гидросульфида натрия, 4) 10-2М раствор дигидрофосфата натрия, 5) 10-3М раствор гидроарсената натрия, 6) 10-1M раствор формиата аммония, 7) 10-1М раствор карбоната аммония, 8) 10-2М раствор гидрофосфата аммония. 9. РАСЧЕТ рН В РАСТВОРАХ СМЕСИ КИСЛОТ И ОСНОВАНИЙ. Рассмотрим случай присутствия в растворе слабой кислоты НА общей концентрации СНА и слабого основания В общей концентрации СВ. В результате реакции между ними общая концентрация форм, которые потеряли протоны (ОН- и А-) должна быть равна общей концентрации форм, которые их приобрели (Н+ и ВН+), то есть запишем уравнение электронейтральности: Из уравнений материального баланса: и выражений для констант диссоциации: получим Подставив эти выражения в уравнение электронейтральности и заменив Задачи. 1) Вычислить рН раствора, содержащего смесь: 10-3 моль/л соляной кислоты, 10-2 моль/л муравьиной кислоты и 10-1 моль/л уксусной кислоты. 2) Рассчитать концентрацию ионов водорода в смеси 10-2моль/л угольной кислоты и 10-1 моль/л хлористого аммония. 3) Рассчитать концентрацию ионов водорода в растворе: 5·10-2 моль/л гидрокарбоната натрия + 10-1 моль/л ацетата натрия. 4) Вычислить рН в растворе ацетата натрия 5·10-2 моль/л, насыщенного углекислотой до концентрации 2·10-2 моль/л. 5) Вычислить рН в 10-2М растворе сероводорода после добавления к нему ацетата натрия в количестве 10-2 моль/л.
6) Как изменится рН, если к 20 мл 0,1 М раствора NH4 HS добавить 10 мл 0,1 М раствора HCl? 7) Сколько г гидроксида натрия необходимо добавить к 100 мл смеси кислот (0.1 моль/л соляной + 0,1 моль/л уксусной), чтобы получить буферный раствор с рН 4,7. К 20 мл смеси уксусной и муравьиной кислот, суммарной концентрации 0,1 моль/л добавили 20 мл 0,05 М раствора гидроксида натрия. рН раствора установилось 4,3. Найти концентрации кислот в исходном растворе.
|
|||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 162; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.130.24 (0.004 с.) |
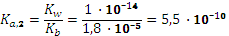 . В нашем случае в качестве Ка,1 будет фигурировать константа диссоциации муравьиной кислоты, а второй будет константа кислотной диссоциации иона аммония.
. В нашем случае в качестве Ка,1 будет фигурировать константа диссоциации муравьиной кислоты, а второй будет константа кислотной диссоциации иона аммония.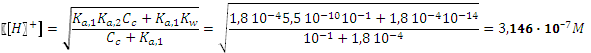 .
.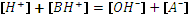
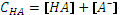 ;
; 
 ,
, 
 и
и  .
. на
на  , можно получить уравнение четвертой степени относительно
, можно получить уравнение четвертой степени относительно 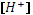 , которое позволяет решить все вопросы, связанные со смесями слабых кислот и оснований. Из этого общего уравнения путем разумных допущений и приближений можно прийти ко всем упрощенным формулам, которые мы использовали ранее.
, которое позволяет решить все вопросы, связанные со смесями слабых кислот и оснований. Из этого общего уравнения путем разумных допущений и приближений можно прийти ко всем упрощенным формулам, которые мы использовали ранее.


