
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролиз электролитов. Закон Фарадея
Электролиты – химические соединения (вещества), распадаю-щиеся на ионы в растворах или расплавах и проводящие элект-рический ток (NaCl, HCl, KOH и т.д.). Электролиз – это окислительно-восстановительный процесс, про-текающий на электродах при прохождении электрического тока через расплав или раствор электролита. При электролизе химическая реак-ция протекает за счет энергии электрического тока, который подво-дится от внешнего источника тока. Устройство, в котором проводят электролиз, называется электролизером или электролитической ван-ной. Электрод, на котором протекает реакция окисления, называется анодом (знак – (+)). Анод принимает электроны от анионов. Элект-род, на котором протекает реакция восстановления, называется катодом (знак – (−)). Катод отдает электроны катионам. Количество электронов, полученным анодом, равно количеству электронов, отданных катодом. Например, если в расплав хлорида натрия погрузить инертные электроды (угольные) и пропустить электрический ток, то ионы при-обретут направленное движение: катионы Nа+ будут двигаться к катоду (отрицательно заряженный электрод), а анионы Cl− − к аноду (положительно заряженному электроду). Суммарное уравнение элект-ролиза расплава хлорида натрия:
(−) катод: Nа+ Nа+ + ē → Na, (+) анод: Cl− 2Cl− − 2ē → Cl2, 2Nа+ + 2Сl− → 2Na + Cl2(газ).
Электролиз водных растворов электролитов является более слож-ным, так как в процессе могут участвовать молекулы воды. Поэтому при электролизе водного раствора хлорида натрия теоретически могут протекать следующие реакции: · окисление на аноде:
2Cl− − 2ē → Сl2 или 2Н2О − 4ē = O2 + 4Н+.
· восстановление на катоде:
2Н2О + 2ē = Н2 + 2OH−.
Суммарное уравнение процесса:
2Cl− + 2Н2О → Cl2 ↑ + Н2↑+ 2OH−.
Чтобы определить, какой из возможных процессов будет про-текать, нужно помнить следующие правила для процессов восста-новления, протекающих на катоде. 1. В водных растворах, содержащих катионы металлов с боль-шим стандартным электродным потенциалом, чем у водорода (от Сu2+ до Аu3+), восстанавливаются ионы металлов. 2. Катионы металлов с потенциалом меньшим, чем у водорода, но большим, чем у алюминия (от Al3+ до H+), при электролизе на катоде восстанавливаются одновременно с молекулами воды.
3. Если же водный раствор содержит катионы различных ме-таллов, то при электролизе восстановление этих металлов на катоде протекает в порядке уменьшения алгебраической величины стандарт-ного электродного потенциала соответствующего металла. Из смеси катионов Аg+, Сu2+, Fе2+ первыми будут восстанав-ливаться катионы серебра (Е о = + 0,80 В), затем катионы меди (Е о = Если анод нерастворимый, т.е. инертный (уголь, графит, платина, золото), то в процессе электролиза сначала окисляются анионы бескислородных кислот (кроме плавиковой), затем молекулы воды (с выделением кислорода) и только в последнюю очередь – соли кислородосодержащих кислот и фторидов. При электролизе растворов щелочей идет окисление гидроксид ионов. Если используется растворимый анод (железо, медь, цинк, серебро и все металлы, окисляющиеся в процессе электролиза), то независимо от природы аниона всегда идет окисление металла анода:
Ме0 − n ē → Ме n + анод (тв.фаза) (раствор)
Качественные соотношения при электролизе были установлены Майклом Фарадеем в 1827 г. Масса электролита, подвергшаяся химическому превращению, а также массы веществ, выделившиеся на электродах (в виде осадков или газов), прямо пропорциональны количеству протекшего через электролит электричества (заряда) и химическим эквивалентам вещества:
где m – масса электролита, подвергшаяся химическому превращению или масса веществ, выделившихся на электродах в виде осадков или газов, г; Э – эквивалентная масса вещества, г/моль экв; J – сила то- При прохождении одного и того же количества электричества через ряд электролитов массы веществ, восстановившихся на катоде и окислившихся на аноде, пропорциональны их химическим эквива-лентам. Эквивалентом вещества (элемента) Э называется такое его количество, которое взаимодействует с одним молем атомов водорода или с одним эквивалентом любого другого вещества (элемента).
Если J ∙ t = 96500 Кл, то m = Э, т.е. для химического превращения 1 экв электролита необходимо попустить через электролит 96500 Кл (1F–число Фарадея)или 26,8 А·ч (1 А·ч = 3600 Кл). Если J ∙ t = 1 Кл, то m = Э/ F.
Примеры решения типовых задач
Пример 1. Ток силой 2А проходит в течение 1 ч через разбав-ленный раствор H2SO4. Определить объемы водорода и кислорода, которые выделились на электродах при Т = 298К и р = 105 Па (н.у.). Решение. 1.Количество электричества, прошедшего через электролит, составляет:
2А∙1 час = 2 А∙ч или 2∙3600 = 7200 Кл.
2. Так как эквивалент водорода (1/2 моль) занимает объем 11,2 л при н.у., то в нашем случае объем водорода будет равен:
3. Эквивалент кислорода (1/4 моль) занимает 5,6 л, а в нашем случае
Пример 2. Какова была сила тока при электролизе, если за Решение. Эквивалент меди Э (Cu) = [ Ar (Cu)]/2 = 63,55/2 = На выделение 1 моль-экв. меди необходимо 96500 Кл, а на вы-деление 0,03 моль-экв. меди − 240∙60∙ J, где J – искомая сила тока, А. Составим пропорцию: 1 – 96500 Кл, 0,03 – 240∙60∙J, отсюда J = (96500∙0,03)/240∙60 = 28,95/24∙6 = 0,2 А.
Пример 3. Рассмотреть все возможные процессы, протекающие при электрохимической коррозии алюминиевого изделия с медными заклепками в зависимости от состава окружающей среды. Алюминий как более активный металл (φ0Al/Al 3+ = −1,66 B, φ0Cu/Cu2+ = +0,34 B) в образующейся гальванопаре выступает в роли анода, т.е. подвергается коррозии:
А: Al → Al3+ + 3e.
На поверхности меди, выступающей в роли катода, в зави-симости от состава окружающей среды будут протекать процессы деполяризации: а) кислая среда (pH < 7) К:
2Н+ + 2е → Н2;
б) нейтральная или щелочная среда (pH ≥ 7) К:
2Н2О + 2ē = Н2 + 2OH−;
в) атмосферная коррозия (pH ≥ 7) К:
О2 + 2Н2О + 4е = 4ОН–, (pH < 7) К: О2 + 4Н+ + 4е = 2Н2О.
В нейтральной и щелочной среде протекает вторичная реакция:
Al3+ + 3ОН- → Al(OH)3.
Контрольное задание № 1
Задача 1. На основе метода валентных связей (МВС) предпо-ложить пространственное строение молекулы. Из приведенных зна-чений электроотрицательности элементов оценить полярность связи между атомами и является ли молекула диполем исходя из её про-странственного строения. 1. SnCl2 2. CdF2 3. PH3 4. BF3 5. PCl3 6. SiH4 7. CCl4 8. CH3F
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 58; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.180.76 (0.014 с.) |
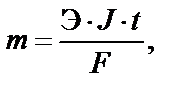 Э = М/ n,
Э = М/ n,




