Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Важнейшие представители и номенклатура кислотСтр 1 из 6Следующая ⇒
Тема 23. Карбоновые кислоты
Карбоновые кислоты – производные углеводородов, содержащие одну или несколько карбоксильных групп
Количество групп –СООН определяет основность кислоты. В задания ЕГЭ входят как одно-, так и двухосновные кислоты. По написанию: здесь будем приводить сокращенное написание, но в ЕГЭ, в заданиях 33 и 35 лучше записывать карбоксильную группу, как По углеводородному радикалу кислоты на предельные (насыщенные) и непредельные (содержащие кратные связи). В отдельную группу выделяют ароматические кислоты, содержащие бензольное кольцо.
Важнейшие представители и номенклатура кислот Одноосновные предельные Общая формула
Общая формула одноосновных предельных кислот
С n H2 n O2
иногда карбоксильную группу выносят в конец
С n H2 n +1СOОН
Многие кислоты имеют традиционные названия, одноосновных предельные кислоты и их соли, которые надо знать, приведены в таблице:
Двухосновные предельные Из двухосновных предельных кислот нужно знать щавелевую (этандиовую) кислоту
и ее соли оксалаты
Иногда щавелевую кислоты записывают в виде эмпирической формулы Н2С2О4, но при решении заданий 33 и 35 необходимо писать только развернутую структурную формулу. Важнейшие непредельные кислоты В ЕГЭ встречаются две непредельные кислоты: акриловая (пропеновая) Н2С=СН–СООН, образующая соли акрилаты;
и олеиновая кислота С17Н33СООН, соли олеаты.
Ароматические кислоты рассмотрим в разделе «Ароматические соединения».
Применение карбоновых кислот Муравьиная кислота применяется для дизенфекции и в качестве консерванта. Уксусная кислота (и уксусный ангидрид) – в пищевой промышленности, для производства синтетических волокон и пластмасс. Пальмитиновая, олеиновая, стеариновая – основа жиров (см. далее). Акриловая, метакриловая – получение полимеров. Простые эфиры Простые эфиры это соединения вида
Простые эфиры рассматриваются как производные спиртов, группа –ОR, остаток спирта, называется алкокси-группой. Слово алкокси- относится к общему алкильному радикалу R, радикал –ОСН3 называется метокси-, – О–СН2–СН3 – этокси- и т.п. По строению углеводородного радикала простые эфиры могут быть предельными, непредельными, циклическими, ароматическими. В кодификаторе ЕГЭ нет свойств простых эфиров, но могут встретится в цепочках как продукты реакций, а также в тестовых заданиях на классификацию соединений. Поэтому очень кратко рассмотрим номенклатуру, получение и основные свойства простых эфиров.
Названия простых эфиров Простые эфиры с одинаковыми радикалами называются симметричными:
H3C–O–CH3 – диметиловый эфир, метоксиметан (межд.)
H3C–CH2–O–CH2–CH3 – диэтиловый эфир, этоксиэтан (межд.)
Несимметричные эфиры: по рациональной номенклатуре радикалы нужно называть в алфавитном порядке H3C–O–CH2–CH3 – метилэтиловый эфир, метоксиэтан (межд.),
но это правило часто нарушается, например в ЕГЭ есть «этилпропиловый эфир»:
H3C–CH2–O–CH2–CH2–CH3 –пропилэтиловый эфир, этоксипропан (межд.)
Предельные ациклические простые эфиры имеют общую формулу
С n H2 n +2O
т.е. такие эфиры изомерны одноатомным спиртам и, к тому же, между собой, например формулу С4Н10 имеют:
диэтиловый эфир H3C–CH2–O–CH2–CH3
метилпропиловый эфир H3C–O–CH2–CH2–CH3
метилизопропиловый эфир
и 2 бутиловых спирта: бутанол-1 H3C–CH2–CH2–CH2–OН
бутанол-2 H3C–CH2–CH2OН –CH3
Получение простых эфиров 1. Реакция Вильямсона – взаимодействие галогенпроизводных и спиртов (смотри свойства галогенпроизводных)
R1–О–К + Г–R ® R1–О–R + КГ
2. Дегидратация спиртов (см. также свойства спиртов, п. 4 а)
R1–OH+НО–R2 см. видео https://youtu.be/vs8nE-ntXWs
3. Простые эфиры можно получить и алкилированием алкенов: при присоединении к алкену спирта в присутвии:
CH3–CH=CH2 + CH3ОН ®
Алкилирование – введение алкильного заместителя в молекулу органического соединения.
Применение простых эфиров
Все простые эфиры – отличные растворители. Самый популярный эфир – диэтиловый (или серный, это старое его название), также применяется в медицине как наркоз.
Сложные эфиры
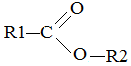
Сложные эфиры это соединения вида
Их можно рассматривать как производное кислоты, в которой группа –ОН заменена на остаток спирта –OR. Название сложных эфиров начинается с названия спирта с окончанием «-ил» и названия кислотного остатка, т. е. в рассмотренной общей формуле R2-ил R1-ат, причем названия радикалов кислотных остатков допускается и по международной и по рациональной номенклатуре, например:
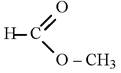
метиловый эфир муравьиной кислоты
изопропиловый эфир уксусной кислоты
Если эфир образован одноосновной предельной кислотой и предельным одноосновным спиртом, то общая формула эфира С n H2 n O2
такие эфиры изомерны предельным одноосновным карбоновым кислотам, например:
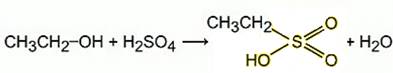
Сложные эфиры могут быть у неорганических кислот: азотной, серной, борной. Например, при температуре около 100 °С этиловый спирт образует с серной кислоты кислый сложный эфир – этилсульфат или т.н. этилсерную кислоту:
Образование сложный эфир ортоборной кислоты и этанола (триэтилбората) см. здесь https://youtu.be/IhBa01vfwrk?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
Образование сложного эфира азотной кислоты и глицерина – нитроглицерина см. в свойствах спиртов.
Перечислим основные способы получения сложных эфиров (подробнее см. свойства спиртов и карбоновых кислот): 1. Реакция этерификации (т.е. эфирообразования), эфир = эстер = этер – слово происходит от греческого αἰθήρ. 2. Взаимодействие ангидридов и галогенангидридов со спиртами. 3. Взаимодействие солей карбоновых кислот и галогеналканов – очень много реакций в ЕГЭ.
Взаимодействие с аммиаком. При взаимодействии с аммиаком образуются амиды кислот и спирты:
!4. У эфиров муравьиной кислоты есть альдегидная функциональная группа, например:
поэтому эфиры муравьиной кислоты проявляют свойства альдегидов, например, вступают в реакцию серебряного зеркала. Это одна из любимых ловушек ЕГЭ. 5. Сложные эфиры, имеющие в своем составе кратные связи (в радикале кислоты или спирта), способны к реакциям присоединения. Эту возможность используют для перевода жидких жиров в твердые, см. жиры.
Применение сложных эфиров
1. Сложные эфиры – растворители. 2. Почти все они интересно пахнут. 3. Производство ПВА – поливинилацетата при полимеризации винилацетата (винилового эфира уксусной кислоты).
4. Жиры – сложные эфиры, их используют в пищу, в химических синтезах, для производства мыла.
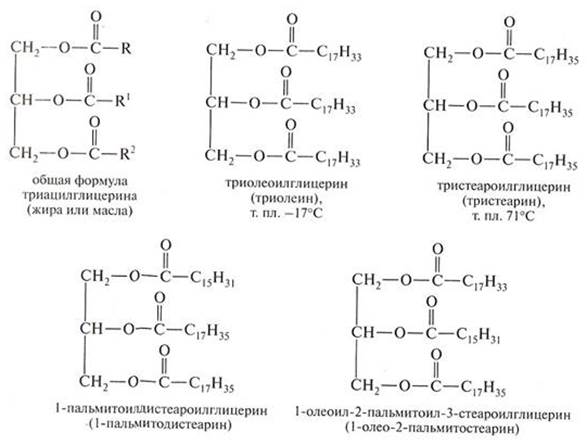
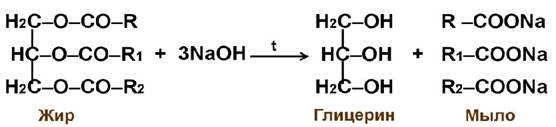
Жиры Жиры – сложные эфиры, образованные высшими одноосновными карбоновыми кислотами, главным образом пальмитиновой, стеариновой и олеиновой и трехатомным спиртом глицерином. Их общее название – триглицериды. Общая формула:
Кислоты могут быть разные, даже в одной формуле сложного эфира, но спирт всегда один – глицерин, например (https://poznayka.org):
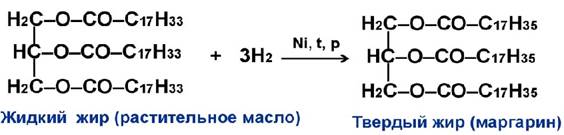
Жидкие жиры – масла – обычно образованы непредельными кислотами. См. видео https://youtu.be/oBBDphN2B-c?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
Их можно насытить водородом (реакция гидрогенизации) и получить т.н. гидрогенизированные твердые жиры, например (https://infourok.ru):
Из жиров традиционно варили мыла: сложный эфир – жир подвергали гидролизу (омылению) в присутствии щелочей (https://infourok.ru):
Мыла (исторически) – натриевые и калиевые соли высших карбоновых кислот (из жиров). Натриевые мыла твердые, калиевые – жидкие. Ионы Са2+ и Mg2+, которые всегда содержатся в природной воде и придают ей т.н. жесткость, дают осадок с «природными» мылами. В настоящее время используют синтетические мыла. см. видео https://youtu.be/du9IpgVoGK4?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
https://youtu.be/WYl9cMP5Iks?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
Тема 23. Карбоновые кислоты
Карбоновые кислоты – производные углеводородов, содержащие одну или несколько карбоксильных групп
Количество групп –СООН определяет основность кислоты. В задания ЕГЭ входят как одно-, так и двухосновные кислоты. По написанию: здесь будем приводить сокращенное написание, но в ЕГЭ, в заданиях 33 и 35 лучше записывать карбоксильную группу, как По углеводородному радикалу кислоты на предельные (насыщенные) и непредельные (содержащие кратные связи). В отдельную группу выделяют ароматические кислоты, содержащие бензольное кольцо.
Важнейшие представители и номенклатура кислот Одноосновные предельные Общая формула
Общая формула одноосновных предельных кислот
С n H2 n O2
иногда карбоксильную группу выносят в конец
С n H2 n +1СOОН
Многие кислоты имеют традиционные названия, одноосновных предельные кислоты и их соли, которые надо знать, приведены в таблице:
Двухосновные предельные Из двухосновных предельных кислот нужно знать щавелевую (этандиовую) кислоту
и ее соли оксалаты
Иногда щавелевую кислоты записывают в виде эмпирической формулы Н2С2О4, но при решении заданий 33 и 35 необходимо писать только развернутую структурную формулу.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 79; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.168.16 (0.091 с.) |
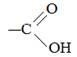 или, сокращенно, –СООН
или, сокращенно, –СООН
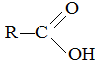 или, сокращенно, R–СООН
или, сокращенно, R–СООН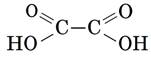 или НООС–СООН
или НООС–СООН или (СОО)22–
или (СОО)22–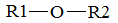
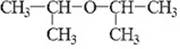 – диизопропиловый эфир, 2-изопропоксипропан (межд.)
– диизопропиловый эфир, 2-изопропоксипропан (межд.)
 R1–O–R2+H2O
R1–O–R2+H2O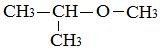

 метилформиат (метилметаноат)
метилформиат (метилметаноат)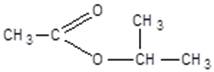 изопропилацетат (изопропилэтаноат)
изопропилацетат (изопропилэтаноат)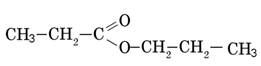 пропилпропионат изомерен капроновой кислоте
пропилпропионат изомерен капроновой кислоте
 + NH3 ®
+ NH3 ® 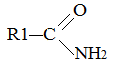 + R2–OH
+ R2–OH