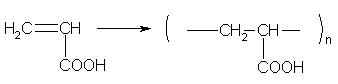Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода . ⇐ ПредыдущаяСтр 3 из 3
III. Использование реактива Гриньяра R-MgBr + CO2 → R-COO-MgBr H2O → R-COOH + Mg(OH)Br
Специфические способы. 1. Получение муравьиной кислоты: а) окисление метана: 2CH4 + + 3O2 t , kat → 2HCOOH + 2H2O б) из оксида углерода (II) 1 стадия: CO + NaOH t , p → HCOONa (формиат натрия – соль) 2 стадия: HCOONa + H2SO4 → HCOOH + NaHSO4 в) из щавелевой кислоты – реакцией декарбоксилирования (t -170⁰) HOOC - COOH → HCOOH + CO2↑ 2. Получение уксусной кислоты: а) окисление бутана: 2CH3-CH2-CH2-CH3 + 5O2 t,kat,p → 4CH3COOH + 2H2O б) ферментативное брожение спирта: CH3-CH2-OH + O2 → CH3-COOH + H2O в) из метанола – оксосинтезом: CH3OH + CO t , p → CH3COOH 3. Получение бензойной кислоты – из альдегида: 2C6H5COH + NaOH → CH3-COONa + C6H5CH2 OH
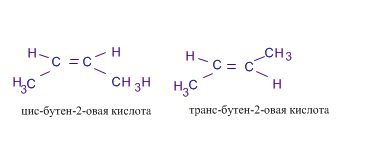
Непредельные (ненасыщенные) кислоты - содержат кратные связи Кислоты с одной двойной связью в молекуле имеют общую формулу CnH 2 n -1 COOH или CnH 2 n -2 O 2. Важнейшие представители: СН2=СН-СООН пропеновая, акриловая СН3–СН=СН–СООН бутен-2-овая, кротоновая Из высших: C 17 H 33 COOH или СН3–(СН2)7–СН=СН–(СН2)7–СООН октадецен-9-овая, олеиновая Особенно важны полиненасыщенные кислоты с несколькими двойными связями: линолевая СН3–(СН2)4 -СН=СН–СН2–СН=СН–(СН2)7–СООН или C17H31COOH с двумя двойными связями, линоленовая СН3–СН2–СН=СН–СН2- СН=СН–СН2–СН=СН –(СН2)7–СООН илиC17H29COOH с тремя двойными связями. Изомерия и номенклатура I. Структурная а) изомерия углеродного скелета (начиная с C4) б) положения кратной связи в) межклассовая со сложными эфирами R- CO – O- R1 II. Пространственная Цис- транс – изомерия Пример:
Изомеры состава С4 H 6 O 2 СН3–СН=СН–СООН бутен-2-овая, кротоновая СН2=СН-СН2–СООН бутен-3-овая, винилуксусная СН2=С(СН3)–СООН 2-метил бутеновая, метакриловая кислота СН2=СН-СОО-СН3 метиловый эфир акриловой кислоты, метилакрилат Физические свойства непредельных кислот Низшие члены этого ряда при обычных условиях представляют собой жидкости, Высшие кислоты-жидкие вещества, нерастворимые в воде, без запаха. Олеиновая кислота представляет собой бесцветную жидкость, затвердевающую на холоде. Химические свойства непредельных карбоновых кислот. Химические свойства непредельных карбоновых кислот обусловлены наличием: а) карбоксильной группы
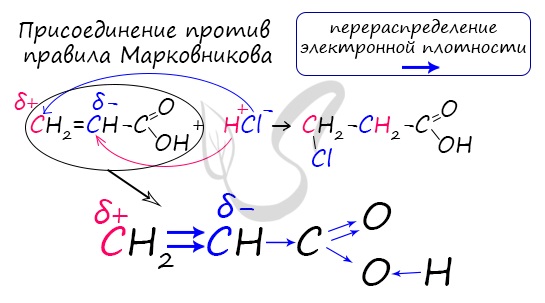
б) двойной связи I. Реакции с участием карбоксильной группы- это реакции, характерные для всех карбоновых кислот (см. выше). II. Реакции по двойной связи: а) реакции присоединения СН2=СН-СООН + Н2 → СН3-СН2-СООН СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН СН2=СН-СООН + HCl → СН2Сl-СН2-СООН СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН Две последние реакции протекают против правила Марковникова
б) реакции полимеризации:
в) реакции окисления: СН2=СН-СН2–СООН + KMnO4 + H2SO4→ СН2=СН-СН2–СООН + KMnO4 + H2O →
|
|||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 120; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.99.7 (0.005 с.) |